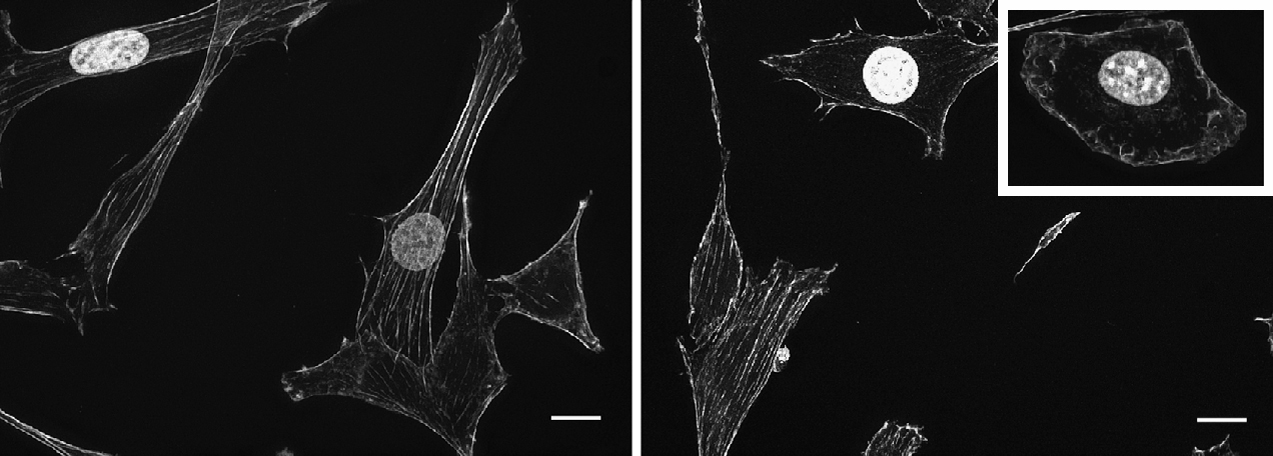
 Trümmer versperren den Weg zum Zellkern: DYRK1A bewirkt, dass Fasern in der Zelle fragmentiert bleiben (Bild rechts, oberer Bildrand), während sie normalerweise ein Gerüst aufbauen (links). © Autoren / AG Lauth
Trümmer versperren den Weg zum Zellkern: DYRK1A bewirkt, dass Fasern in der Zelle fragmentiert bleiben (Bild rechts, oberer Bildrand), während sie normalerweise ein Gerüst aufbauen (links). © Autoren / AG LauthMenschen mit Down-Syndrom besitzen ein überzähliges Chromosom. Diese genetische Abweichung geht mit einer höheren Konzentration des Proteins DYRK1A in den Körperzellen einher, weil sich die Bauanleitung für das Protein auf dem betroffenen Chromosom 21 befindet; sie liegt also in einer zusätzlichen Kopie vor.
„Unsere Ergebnisse erklären, inwiefern DYRK1A der Tumorbildung entgegenwirkt“, sagt Mitverfasser Lauth, der eine Nachwuchsgruppe am Zentrum für Tumor- und Entzündungsforschung der Philipps-Universität leitet.
DYRK1A ist bekannt dafür, dass es die Hedgehog-Signalkaskade aktiviert, das an verschiedenen Krebserkrankungen beteiligt ist. Wie das Autorenteam herausfand, kann DYRK1A aber auch in gegensinniger Richtung wirken und Hedgehog hemmen, indem es nachgeschaltete Proteine behindert. Diese dienen eigentlich dazu, das Hedgehog-Signal bis zum Zellkern weiter zu geben, wo dann weitere Gene angeschaltet werden.
Vorstellbar ist dies wie eine Folge von Staffelläufern, die sich abwechseln und ihre Stafette weiterreichen, bis das Ziel erreicht ist – in diesem Fall die Kommandozentrale der Zelle.
Mögliche neue Therapieoptionen für Krebserkrankungen
Damit die Proteine dieser Signalkette zum Zellkern transportiert werden, sind sie auf das Zellgerüst angewiesen. Lauth und seine Koautoren präsentieren mikroskopische Aufnahmen, die belegen: DYRK1A verhindert das Wachstum der Fasern, aus denen das Gerüst besteht – der Weg wird sozusagen unpassierbar.
„Unsere Ergebnisse bieten einen mechanistischen Rahmen, um die negative Wirkung von DYRK1A auf den Hedgehog-Signalweg zu erklären, der zu Tumorerkrankungen führen kann“, fasst der Studienleiter die Resultate zusammen. Die Erkenntnisse der Autorinnen und Autoren könnten neue Therapieoptionen eröffnen, um Krebserkrankungen erfolgreich zu bekämpfen.
Das Zentrum für Tumor- und Entzündungsforschung (ZTI) der Philipps-Universität führt molekular- und zellbiologische Arbeitsgruppen zusammen, die sich der Erforschung von Krebserkrankungen und der Immunregulation widmen. Der Arbeitsschwerpunkt liegt auf der Aufklärung der Wechselwirkungen, die zwischen Entzündungen und der Entwicklung von Tumoren bestehen.
Quelle: Philipps-Universität Marburg
Weitere Informationen
Originalveröffentlichung: Philipp Schneider & al.: Identification of a novel actin-dependent signal transducing module allows for the targeted degradation of GLI1, Nature Communications 2015, DOI: 10.1038/ncomms9023