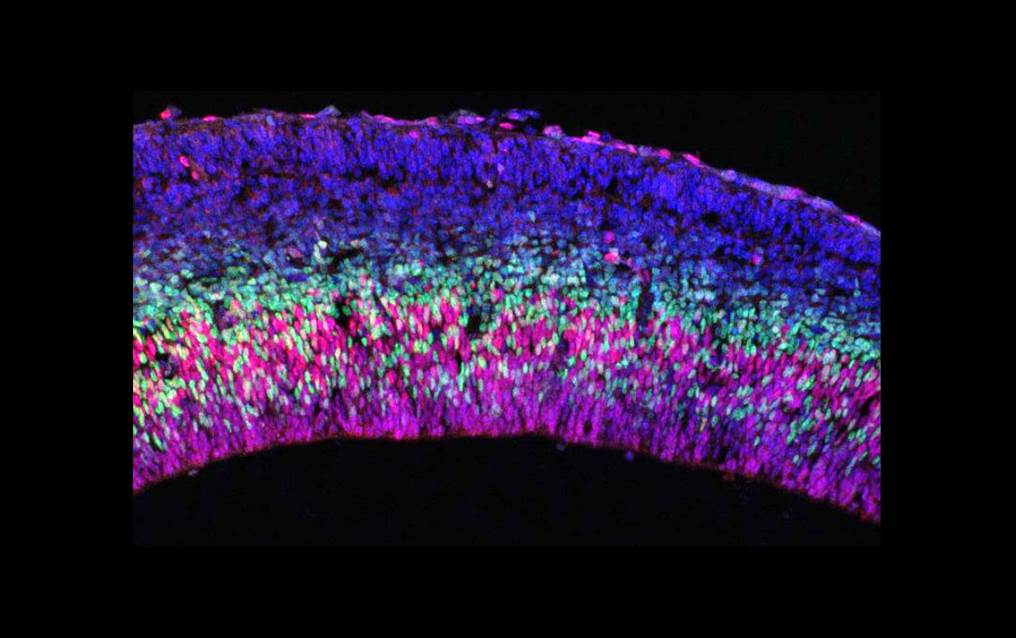
Um den Einfluss früher epigenetischer Modifikationen auf die Entwicklung der Nervenzellen zu untersuchen, schalteten die Wissenschaftler im Mausmodell ein bestimmtes Gen aus, das Gen Uhrf1. „Von ihm ist bekannt, dass es mehrere epigenetische Funktionen hat, u.a. die DNA Methylierung steuert und ausschließlich in sehr frühen Stadien der Neurogenese aktiv ist“, sagt Götz.
Durch die DNA Methylierung werden Gene in der Regel abgeschaltet. Das Ausschalten von Uhrf1 hatte zur Folge, dass eigentlich stillgelegte retrovirale Gensequenzen nach Demethylierung mithilfe sogenannter Tet-Enzyme dann aktiviert wurden. Diese Aktivierung blieb auch in späteren Stadien der Neurogenese und postnatal bestehen – die Zelle konnte also die einmal erfolgte Fehlsteuerung nicht mehr reparieren.
Schädigung bis zum Zelltod
Langfristig führt eine Aktivierung von retroviralen Sequenzen zu weiteren Fehlern in der Genregulation und zur Anreicherung retroviraler Proteine in der Zelle. Dadurch werden die Zellen zunehmend geschädigt, bis es zum massiven Zelltod kommt.
„Unsere Ergebnisse zeigen, dass Schlüsselfaktoren der frühen Neurogenese wie das Gen Uhrf1 weitreichende Auswirkungen auf das Zellschicksal haben, deren Folgen sich erst Wochen später zeigen“, sagt Götz. „Unser Modell ermöglicht einen faszinierenden Einblick in diese Mechanismen, die auch für das Verständnis neurodegenerativer Erkrankungen wichtig sind.“
Quelle: Helmholtz Zentrum München
Originalpublikation: Ramesh, V. et al.; Loss of Uhrf1 in neural stem cells leads to activation of retroviral elements and delayed neurodegeneration; Genes & Dev., 2016; doi: 10.1101/gad.284992.11