Dass die so genannten Bändersynapsen der inneren Haarzellen eine Schlüsselrolle bei der Signalumwandlung vom akustischen Reiz in ein Nervensignal haben, ist seit einigen Jahren bekannt. Die besonderen Synapsen der inneren Haarzellen sind durch ihren speziellen Aufbau auf die schnelle und präzise Reizumwandlung optimal abgestimmt.
Ebenso war schon bekannt, dass die räumlich präzise Verankerung Dutzender Kalziumkanäle wichtig für das Funktionieren der Bändersynapsen ist. Viele verschiedene Proteine müssen für die Vorgänge, wie die Freisetzung von Botenstoffen, an der Synapse koordiniert zusammenspielen. Bislang ist jedoch noch nicht geklärt, welche Proteine genau daran beteiligt sind.
Jetzt steht fest: Fehlt das Protein RIM2 oder ist es genetisch verändert, werden die Kalziumkanäle in zu geringer Anzahl angelegt. Die Folge: Die Bändersynapsen funktionieren nicht mehr richtig. Die Ergebnisse weisen auf Ursachen für mögliche Störungen bei der Umwandlung oder der Weiterleitung des Hörsignals hin. Diese können zu Schwerhörigkeit führen.
Proteinmaschinerie der Bändersynapsen
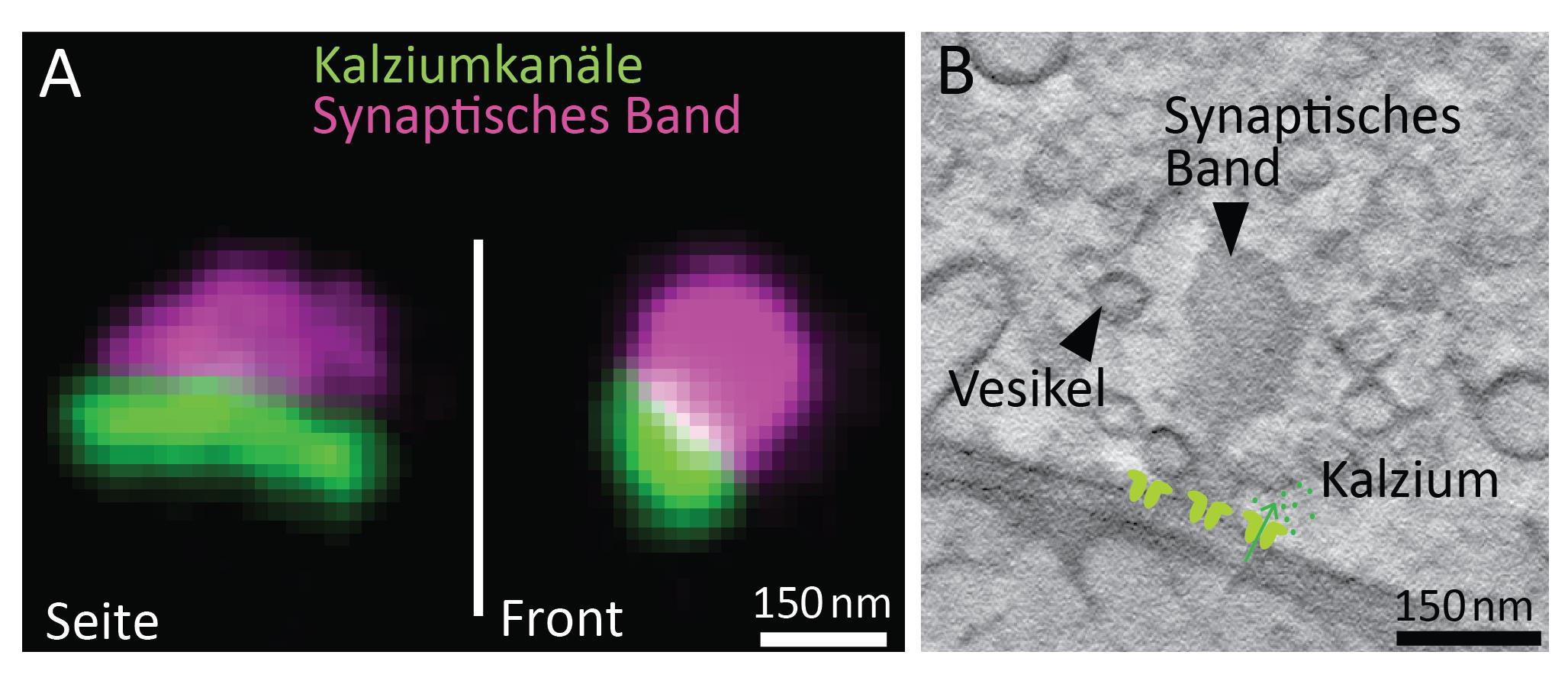 STED-Aufnahmen von Kalziumkanälen, die an der synaptischen Membran der Bändersynapsen angeordnet sind (grün). Das synaptische Band ist konfokal aufgenommen und hier in Magenta dargestellt. (Abb. B) Virtueller Schnitt aus einer 3D-Rekonstruktion einer Bändersynapse aufgenommen mit einem Transmissions-Elektronenmikroskop. © umg/Jung und Chakrabarti
STED-Aufnahmen von Kalziumkanälen, die an der synaptischen Membran der Bändersynapsen angeordnet sind (grün). Das synaptische Band ist konfokal aufgenommen und hier in Magenta dargestellt. (Abb. B) Virtueller Schnitt aus einer 3D-Rekonstruktion einer Bändersynapse aufgenommen mit einem Transmissions-Elektronenmikroskop. © umg/Jung und ChakrabartiBisher nahm die Grundlagenforschung an, dass die Botenstofffreisetzung an den Bändersynapsen zum Großteil anders abläuft als in anderen (konventionellen) Synapsen. Diese Vermutung lag nahe, weil sich die Proteinmaschinerie der Bändersynapsen in ihrem molekularen Aufbau entscheidend von anderen Synapsen unterscheidet. Sonst sehr gängige und wichtige Komponenten für die Botenstofffreisetzung schienen an den Bändersynapsen der inneren Haarzellen zu fehlen. Dafür besitzen sie teilweise ganz andere Moleküle.
Mit dem Rab3-Interaktions-Molekül (RIM) haben die Göttinger Hörforscher nun ein Protein entdeckt, das an konventionellen Synapsen vorhanden ist und ebenfalls eine wichtige Rolle an den Bändersynapsen im Innenohr spielt. RIM ist ein typisches Protein der sogenannten Zytomatrix an der aktiven Zone von Synapsen. Diese Zytomatrix besteht aus zahlreichen Proteinen, die der Vesikelrekrutierung, -freisetzung, der Verankerung von Kalziumkanälen oder der Strukturgebung dienen.
„Mit unserer Entdeckung konnten wir zeigen, dass die Proteinmaschinerie doch teilweise ähnlich ist. Allerdings kommen in den Bändersynapsen andere Varianten von RIM zum Einsatz, nämlich RIM2, RIM1 hingegen ist im Gegensatz zu anderen Synapsen nicht vorhanden“, sagt Dr. Carolin Wichmann, Seniorautorin der neuen Studie und Arbeitsgruppenleiterin im Institut für Auditorische Neurowissenschaften der Universitätsmedizin Göttingen.
Ergebnisse im Detail
Mittels hochauflösender STED-Mikroskopie konnten die Göttinger Hörforscher zudem aufklären, dass RIM2 in direkter Nähe zu den Kalziumkanälen an der Synapse lokalisiert. In Mäusen, denen das Protein RIM2 fehlt, sind weniger Kalziumkanäle in der synaptischen Membran vorhanden.
„Mit zellphysiologischen Messungen konnten wir aufklären, dass bei Abwesenheit von RIM2 Protein weniger von dem benötigten Kalzium in die Zelle einströmt. Dies hat zur Folge, dass die Freisetzung der Botenstoffe vermindert ist“, sagt Dr. Sangyong Jung, Wissenschaftler am Institut für Auditorische Neurowissenschaften der UMG und ebenfalls Erstautoren der Studie.
Weitere Details bei genetisch veränderten Synapsen konnten die Göttinger Hörforscher mit dem Elektronenmikroskop in 3D (siehe Abb. oben) erkennen. Es zeigte sich, dass weniger Vesikel an der synaptischen Membran über dünne Filamente gebunden sind.
„Wir vermuten, dass diese Filamente an der Synapse mithelfen, synaptische Vesikel zur Membran zu führen. So wird offenbar sichergestellt, dass möglichst viele Vesikel mit der Membran verschmelzen und ihre Botenstoffe freisetzen können. Liegen weniger gebundene Vesikel vor, so kann dies bereits die Freisetzung verringern“, sagt Dr. Carolin Wichmann. Die Weiterleitung des Signals über den Hörnerv ist ebenfalls beeinträchtigt und führt in den betroffenen mutanten Mäusen zu einer Hörstörung.