„Unsere Ergebnisse sind einerseits reine Grundlagenforschung“, sagt Professor Ferdinand le Noble vom Zoologischen Institut des KIT, „jedoch eröffnen sie eine völlig neue Sicht darauf, wie Blutgefäße wachsen, sich verästeln oder in ihrem Wachstum gehemmt werden.“
Seit Jahrzehnten suchen Forscher nach Möglichkeiten, die Bildung neuer Blutgefäße gezielt zu fördern oder zu hemmen. Herzinfarkt- und Schlaganfallpatienten würden von neuen Versorgungsbahnen profitieren. Bei Krebspatienten hungert ein Stopp der einwachsenden Blutgefäße Tumore aus.
Unerwünschte Nebenwirkungen
Schlüsselfiguren in dem nun entdeckten und extrem fein abgestimmten Verlauf sind Signalmoleküle wie sFlt1, die Wachstumsbremse und VEGF, der Wachstumsfaktor. Ausgeschrieben steht die Abkürzung sFlt1 für „soluble FMS-like Tyrosine kinase-1“ und VEGF für „Vascular Endothelial Growth Factor“. Wie genau der Körper VEGF reguliert war bisher unbekannt.
Trotzdem wird bereits seit Jahren die Hemmung des Wachstumsfaktors VEGF bei der Behandlung von Krebspatienten und bestimmten Augenerkrankungen therapeutisch eingesetzt. Allerdings ist die Therapie nur bei einem Teil der Patienten erfolgreich und zeigt eine Reihe unerwünschter Nebenwirkungen.
„Bis dato ging die Forschung davon aus, dass Blutgefäße über eine gewisse Selbstregulierung ihres eigenen Wachstums verfügen“, erklärt le Noble. „Bei Sauerstoffmangel schüttet Gewebe unter anderem den Wachstumsfaktor VEGF aus und lockt somit Blutgefäße an, die auf ihrer Oberfläche Rezeptoren für VEGF besitzen“, führt er aus. „Wir wollten wissen, wie dieses Gefäßwachstum ganz zu Beginn der Entwicklung eines Lebewesens reguliert ist.“
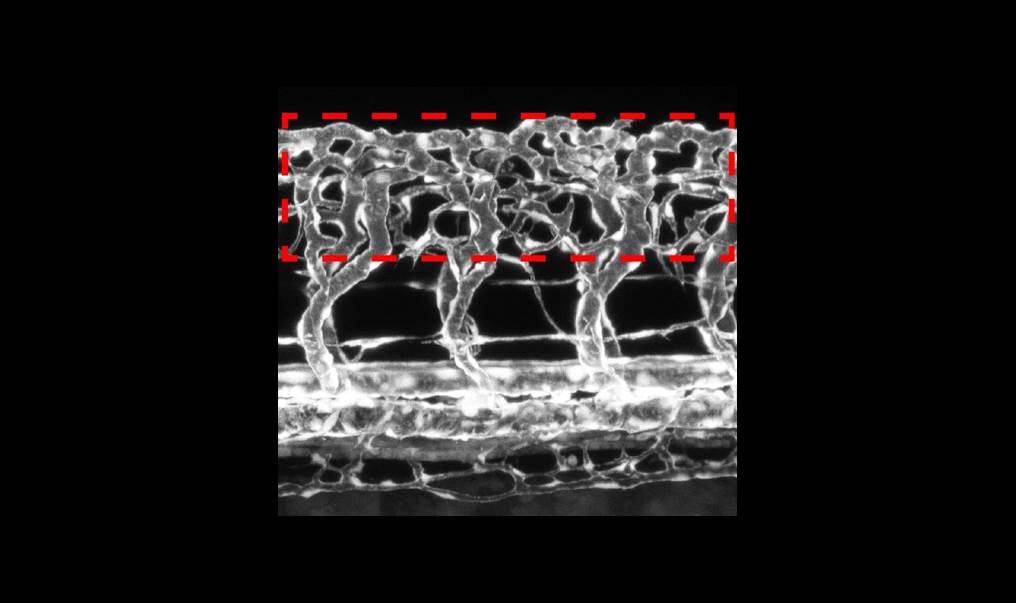
Dazu verfolgte das Team um le Noble das kontinuierliche Wachstum von Nerven- und Blutbahnen im Modellorganismus Zebrafisch. Die Eier des Zebrafischs sind transparent und entwickeln sich außerhalb des Körpers der Mutter: So können Forscher im Embryo oder der ebenfalls durchsichtigen Larve die Entwicklung von Organen oder gar einzelnen Zellen beobachten, ohne das heranwachsende Tier zu schädigen.
Biochemische und genetische Feinanalyse
Mit Hilfe von Fluoreszenzfarbstoffen dokumentierte Doktorand Raphael Wild zunächst, wie Nervenstammzellen zuerst den Wirbelkanal von Zebrafisch-Embryos besiedeln und anschließend Blutgefäße einsprossen. Das Team startete eine biochemische und genetische Feinanalyse, um den genauen Prozess zu verstehen.
Die Wissenschaftler wiesen nach, dass die Nervenzellen des Rückenmarks in unterschiedlichen Entwicklungsstadien mehr oder weniger sFlt1 und VEGF produzieren. Die Zellen modulieren damit die Entwicklung von Blutgefäßen. In der frühen Entwicklungsphase bremst neuronales sFlt1 das Gefäßwachstum, indem es den Wachstumsfaktor VEGF bindet und inaktiviert.
Dadurch wird eine sauerstoffarme Umgebung im Rückenmark geschaffen, welche für die frühe Entwicklung der neuronalen Stammzellen wichtig ist. Bei fortschreitender Ausdifferenzierung der Nervenzellen nimmt die Konzentration des löslichen sFlt1 kontinuierlich ab. Damit wird die Wachstumsbremse für die Blutgefäße gelockert, weil nun mehr aktives VEGF zur Verfügung steht. In der Folge sprießen Blutgefäße in das junge Rückenmark ein, um es mit Sauerstoff und Nährstoffen zu versorgen.
Schwerwiegende Entwicklungsstörungen
Wild und seine Kollegin Alina Klems zeigen zudem, dass die Konzentration des Wachstumsfaktors ausschlaggebend für die Dichte des sich entwickelnden Blutgefäßgeflechts ist. Schalteten sie die „Bremse“ sFlt1 in Nervenzellen komplett aus, bildete sich ein dichtes Blutgefäßnetz, das sogar in den Wirbelkanal hinein wucherte. Erhöhten sie sFlt1 wurde das Wachstum von Blutgefäßen unterdrückt.
Schon kleine Konzentrationsschwankungen der Substanz führten somit zu schwerwiegenden Entwicklungsstörungen von Blutgefäßen. Da Zellen von Blutgefäßen ebenfalls über eigene Formen von sFlt1 und VEGF verfügen, stellte sich die Frage, ob nicht auch eine gewisse Eigenregulierung des Blutgefäßwachstums stattfindet. Hierzu nutzen die Forscher die noch junge und überaus elegante CRISPR/Cas-Methode: Wurde sFlt1 nur in Gefäßzellen ausgeschaltet, zeigte sich kein Effekt.
Schalteten sie hingegen die Produktion von sFlt1 ausschließlich in Nervenzellen ab, so war das Ergebnis ein intensives Wachstum von Blutgefäßen. „Wir schließen aus den Ergebnissen, dass Nervenzellen durch eine feine Modulation von sFlt1 und VEGF das Ausmaß ihres Blutgefäßnetzwerks je nach Bedarf oder Entwicklungsstadium sehr dynamisch selbst bestimmen“, folgert le Noble. „Die bisherige Annahme, dass sprossende Blutgefäßzellen die nachstehenden Gefäßzellen kontrollieren – dieses Dogma der Zellbiologie kippt.“
Quelle: Karlsruher Institut für Technologie (KIT)
Originalpublikation: Ferdinand le Noble et al.; Neuronal sFlt1 and Vegfaa determine venous sprouting and spinal 1 cord vascularization; Nature Communications, 2016; DOI: 10.1038/ncomms13991