Dass Zellen die Bausteine des Lebens sind, steht in jedem Bio-Lehrbuch. Ihre Vielfalt offenbart sich jedoch erst jetzt. Denn nun zeigen Technologien wie die RNA-Sequenzierung, welche Gene in jeder einzelnen Zelle abgelesen werden. Anhand ähnlicher Expressionsprofile kann man sie systematisch ordnen.
„Wann immer wir uns ein Organ oder einen Organismus damit ansehen, finden wir nicht nur bekannte, sondern auch unbekannte und seltenere Zelltypen“, sagt Dr. Jan Philipp Junker, Leiter der Arbeitsgruppe „Quantitative Entwicklungsbiologie“ am Berlin Institute for Medical Systems Biology des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC).
„Die nächste Frage liegt nahe: Woher kommen die verschiedenen Zelltypen?“ Das Team um Junker stellt nun eine Technik namens LINNAEUS vor, mit der sie sowohl den Zelltyp als auch den Ursprung jeder Zelle analysieren können. „Wir wollen die Flexibilität in der Entwicklung von Organismen verstehen“, sagt Junker.
Herkunft der Zellen verrät die wahre Geschichte
Passiert während der embryonalen Entwicklung eine Störung, zum Beispiel durch eine Mutation oder durch Umwelteinflüsse, sorgen Reparaturmechanismen mitunter dafür, dass ein Lebewesen später gesund erscheint. Nur die Herkunft der einzelnen Zellen verrät dann die wahre Geschichte, das Ausmaß der Störung sowie den Reparaturmechanismus.
Selbst das Herz eines erwachsenen Zebrafischs kann sich nach einer Verletzung regenerieren. „Wiederholt sich dabei ein entwicklungsbiologisches Programm oder passiert etwas Neues? Wandeln sich Zellen und übernehmen andere Aufgaben?“, fragt Junker. In anderen Fällen fehlt ein Zelltyp und verursacht damit eine Erkrankung.
Aus den Stammbäumen aller Zellen, die mit LINNAEUS möglich werden, können Forscherinnen und Forscher künftig neue Hypothesen zu solchen Fragen ableiten. Die Technik beruht auf Narben im Erbgut, deren Kombination wie ein Barcode für die Herkunft jeder Zelle funktioniert.
Leuchten des Embryos nimmt ab
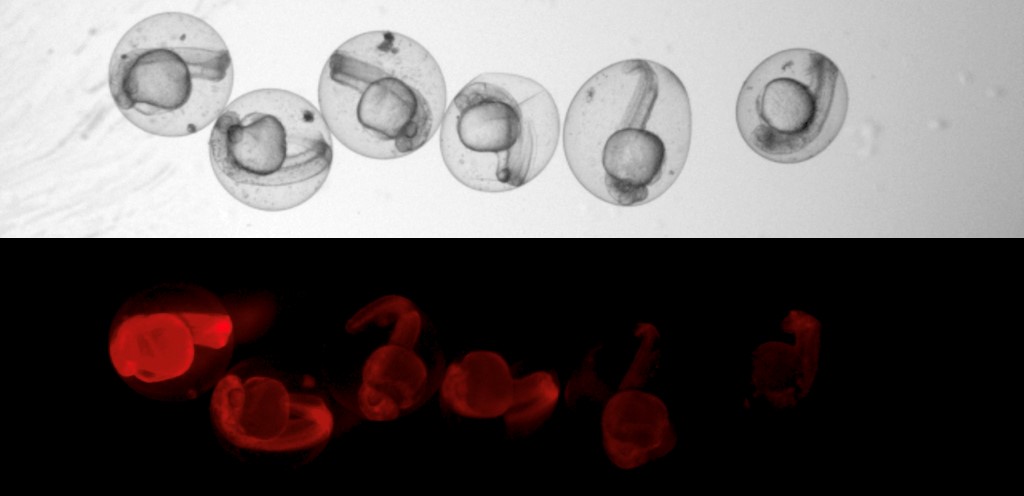
Noch während die Zebrafisch-Embryonen im Ein-Zell-Stadium sind, injiziert Junkers Team die Gen-Schere CRISPR-Cas9. Innerhalb der nächsten acht Stunden zerschneidet die Schere immer wieder eine Sequenz, die der Fisch garantiert nie braucht: das Gen für ein rot fluoreszierendes Protein (RFP).
Das rote Leuchten des Embryos nimmt ab, die Wunden im Erbgut schließen derweil Tausende verschiedener Narben. „CRISPR schneidet zwar immer an genau einer Stelle. Aber die Zellen haben für die Reparatur höchstens eine Viertelstunde Zeit bis zur nächsten Zellteilung“, sagt Junker.
„Also wird schnell geflickt, die Chromosomenstücke irgendwie zusammengeklebt. Dabei passieren Fehler. Die Narben im Erbgut haben eine zufällige Länge, auch die exakte Position ist variabel.“ Bei der Zellteilung werden die genetischen Narben an die Tochterzellen vererbt. Zellen, die auf einen gemeinsamen Vorfahren zurückgehen, können somit anhand ihrer genetischen Narben erkannt werden.
Fehlende Daten überbrücken
Während die Einzelzell-RNA-Sequenzierung Tausende Zellen in Zelltypen ordnet, zeigen die Narben Millionen Verbindungen zwischen den Zellen. Die Herausforderungen, aus diesem Wollknäuel von Daten Stammbäume zu rekonstruieren, waren vielfältig. Zum einen sind manche Narben besonders wahrscheinlich.
„Das ist gefährlich. Denn wenn die gleiche Narben-Sequenz in einer Zelle im Herz und im Gehirn geschaffen wird, könnte man fälschlicherweise davon ausgehen, dass sie einen gemeinsamen Vorfahren haben“, sagt Junker. „Wir mussten also wissen, welchen Sequenzen wir nicht trauen können und sie aussortieren.“
Zum anderen seien nicht immer alle Narben in einer Zelle auffindbar, sagt Bioinformatiker Bastiaan Spanjaard, einer der Erstautoren der Studie. „Wir haben also eine Methode entwickelt, die beim Bauen der Stammbäume die fehlenden Daten überbrücken kann.“ Das Ergebnis sind Stammbäume, an deren Verzweigungen jeweils bunte Kuchendiagramme stehen.
Entwicklung trennt sich früh
Jede Verzweigung ist eine Narbe und jede Farbe in den Kuchendiagrammen zeigt, in welchen Zelltypen sie vorkommt. In diese kondensierte Darstellung eines riesigen Datensatzes können Forscherinnen und Forscher so tief hineinzoomen wie sie möchten.
„Im Herzen gibt es zum Beispiel zwei Zelltypen, die kaum unterscheidbar sind. Aber die Stammbäume zeigen, dass sich ihre Entwicklung sehr früh trennt“, sagt Junker. „Wir wollen als nächstes schauen, wo sie im Fischherz vorkommen. Das gibt oft einen ersten Hinweis auf ihre Funktion.“
Sein Labor bleibt bei den Zebrafischen als Modell. Besonderes Potenzial sieht Junker jedoch auch darin, die Technik bei menschlichen Organoiden anzuwenden. Schließlich könne man dort verstehen, welche Mutation eines Patienten die Zellstammbäume nachhaltig stört.
Quelle: Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
Publikation: Bastiaan Spanjaard et al.; Simultaneous lineage tracing and cell-type identification using CRISPR–Cas9-induced genetic scars; Nature Biotechnology, 2018; doi: 10.1038/nbt.4124