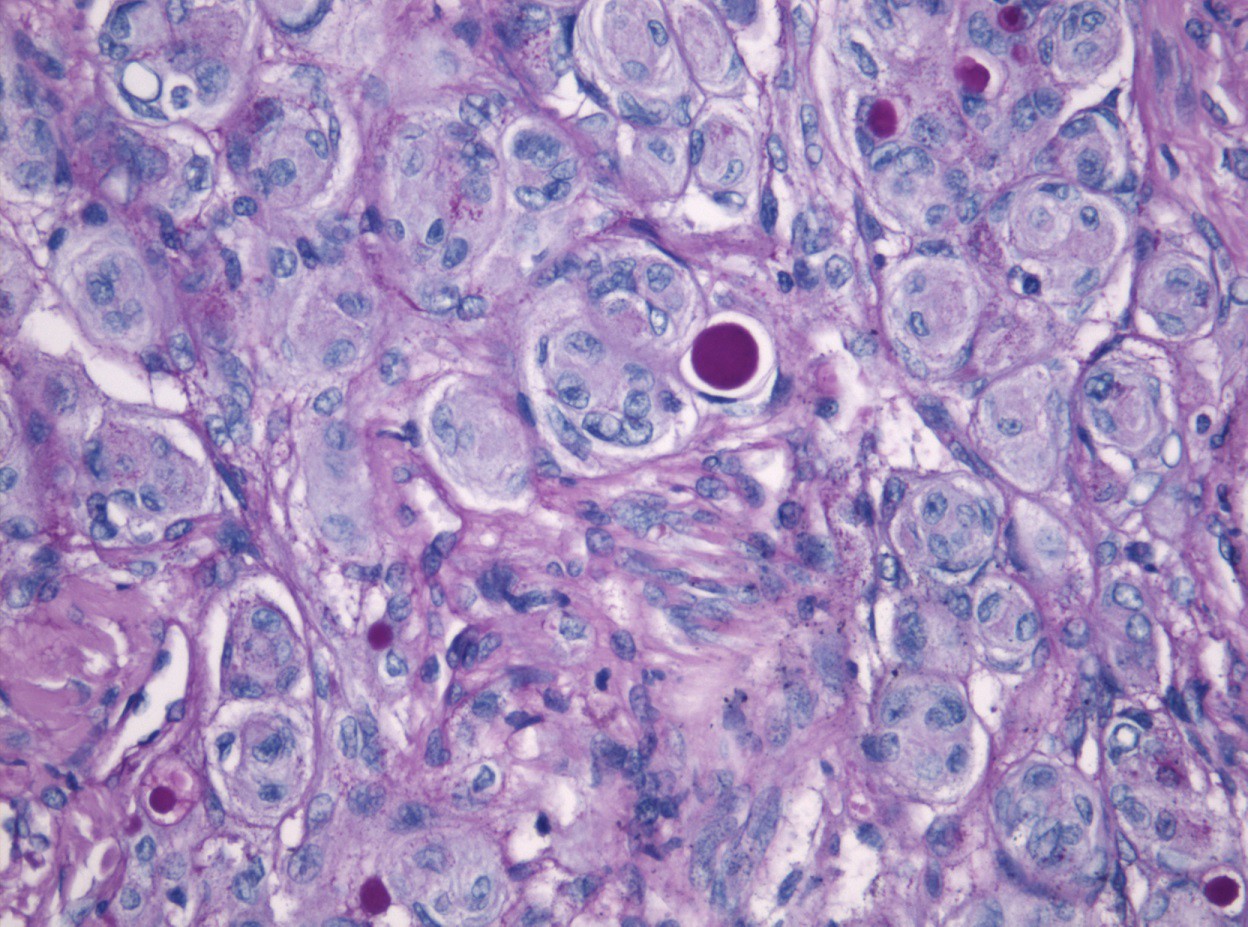
Basis des Systems ist der „molekulare Fingerabdruck" der Tumorzellen, ihr sogenanntes Methylierungsmuster, also das Anheften kleiner biochemischer Gruppen an bestimmte Stellen der DNA. Diese Veränderungen können darüber entscheiden, ob ein Gen abgelesen wird oder nicht. Das Projekt unter Federführung von Dr. Felix Sahm, der eine Arbeitsgruppe der Abteilung Neuropathologie (Ärztlicher Direktor Prof. Dr. A. von Deimling) am Universitätsklinikum Heidelberg und dem Deutschen Krebsforschungszentrum (DKFZ) leitet, wird von der Else Kröner-Fresenius-Stiftung mit insgesamt rund 470 000 Euro unterstützt.
Die Folge ungenauer Klassifikationen sind vermeidbare Rückfälle bei zu harmlos eingestuften und daher fälschlicherweise nicht bestrahlten Tumoren oder unnötige Bestrahlungen im umgekehrten Fall. Die WHO-Einteilung beruht bislang auf dem Erscheinungsbild der Tumorzellen unter dem Mikroskop. Die Heidelberger Forschungsergebnisse tragen dazu bei, unter Berücksichtigung molekularer Marker die WHO-Einteilung zu überarbeiten und damit die Therapie von Hirntumorpatienten zu verbessern.
80 Prozent gutartig
Meningeome sind die häufigsten Hirntumoren bei Erwachsenen. Sie entstehen aus der Hirnhaut und machen etwa ein Drittel aller Hirntumoren aus. Sie werden bislang anhand des Erscheinungsbildes ihrer Zellen gemäß WHO-Klassifikation in die Grade I bis III eingestuft, wobei rund 80 Prozent der Meningeome als gutartig gelten und dem Grad I zugeteilt werden. Die Patienten können durch eine vollständige operative Entfernung des Tumors in der Regel geheilt werden.
Bei Grad II wird individuell entschieden, ob eine anschließende Strahlentherapie notwendig ist. Bei Grad III ist die Wahrscheinlichkeit für Rückfälle am größten, hier werden die meisten Patienten bestrahlt. Aus Sicht von Dr. Felix Sahm war ein genauer Blick auf die Methylierungsmuster als so genannte epigenetische Eigenschaften der Meningeomzellen längst überfällig. Aufgrund intensiver Forschung auf diesem Gebiet können die meisten anderen Arten von Hirntumoren bereits präzise in verschiedene Untergruppen eingeteilt werden.
„Bei den Meningeomen gelang das bislang nicht, weil bis zu 80 Prozent der Tumoren auf der gleichen Mutation im NF2-Gen beruhen, ihr Genom also sehr ähnlich ist. Erst die neuen molekularbiologischen Methoden haben es möglich gemacht, eine feinere Unterscheidung auf Basis epigenetischer Veränderungen zu treffen."
Analyse riesiger Datenmengen
Der Aufwand für die retrospektive Studie war enorm: Über 600 Patienten-Proben von zehn europäischen neuro-onkologischen Zentren wurden insgesamt einbezogen, untersucht wurden jeweils 450 000 Stellen in den rund 30 000 menschlichen Genen. Nach Identifikation der entscheidenden Methylierungsmuster wurden die Patienten-Proben in Gruppen mit gutartigen, mit intermediären und mit bösartigen Tumoren eingeteilt und diese Voraussagen mit der WHO-Klassifizierung und dem tatsächlichen Krankheitsverlauf, den die Patienten durchlebt hatten, verglichen.
In allen Graden konnten Patienten präziser eingeteilt werden, die Fehlerquote war geringer. So trat bei 18 Prozent der 92 Patienten, die nach WHO-Klassifizierung in Grad I, also gutartiger Verlauf, eingeteilt wurden, ein Rezidiv auf. Die Heidelberger Forscher teilten aufgrund der Methylierungsmuster jedoch nur 83 Patienten als „gutartig" ein, 9 Patienten stellten sie eine ungünstigere Prognose.
Tatsächlich entwickelten in der Gruppe mit gutartigem Methylierungsprofil auch nur 12 Prozent Rezidive. In der Gruppe mit molekulargenetisch ungünstigem Profil kam es aber in 78 Prozent zu einem Rezidiv. „Für diese Gruppe wäre also eine engmaschigere Verlaufskontrolle und gegebenenfalls eine Bestrahlung sinnvoll", fasst Dr. Sahm zusammen. Auch Grad II-Patienten konnten anhand der Methylierungsmuster in Untergruppen eingeteilt werden, die eine Entscheidung für oder gegen Bestrahlung erleichtern.
So filterten die Forscher aus 97 Patienten 44 heraus, bei denen das Risiko, einen Rückfall zu erleiden wesentlich geringer ist, als mit der WHO-Einteilung anzunehmen wäre. 4 Patienten konnten sie dagegen ein sehr hohes Risiko zuweisen, was sich durch den Krankheitsverlauf bestätigte. „Auch hier konnten wir mit der Kombination aus zellpathologischen und molekularbiologischen Untersuchungen die Einteilung verbessern."
Quelle: Universitätsklinikum Heidelberg
Publikation: Sahm, Felix et al.; DNA methylation-based classification and grading system for meningioma: a multicentre, retrospective analysis; The Lancet Oncology, 2017; DOI: 10.1016/S1470-2045(17)30155-9