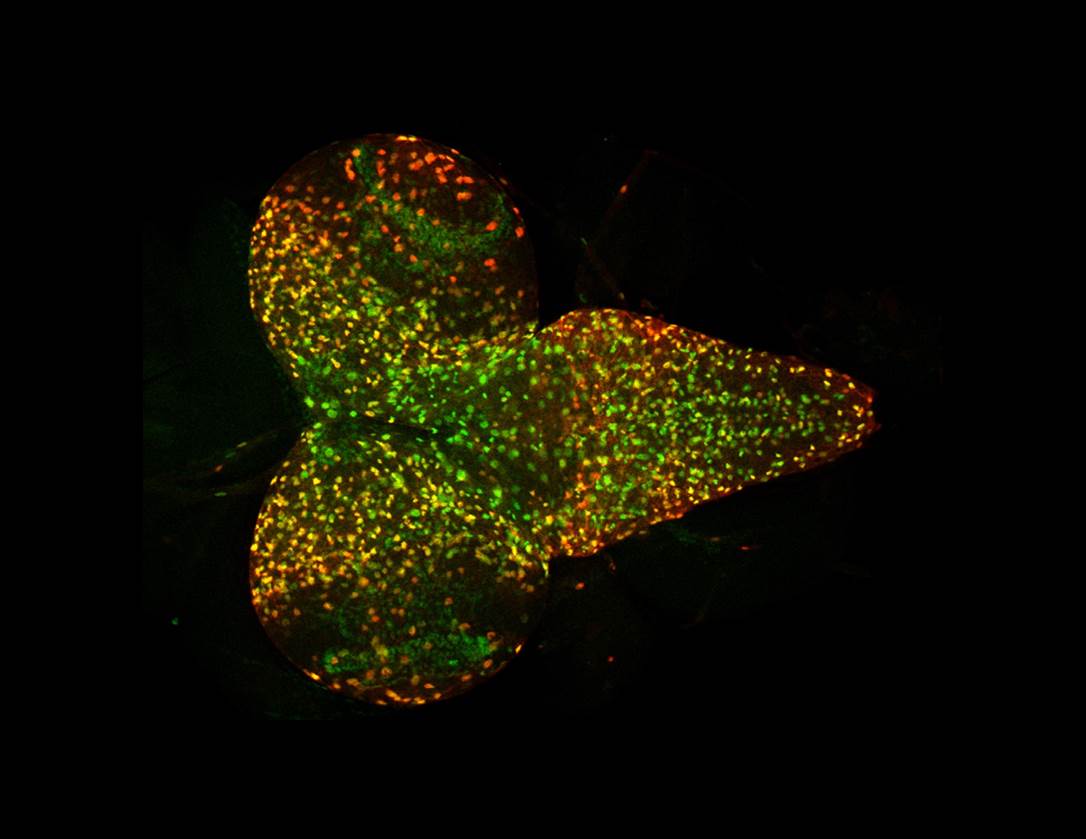
Wie Biologen aus der Arbeitsgruppe Zoologie-Entwicklungsbiologie der Universität Osnabrück in Kooperation mit Wissenschaftlern der Universität Kopenhagen nun herausfanden, wird die Synthese von Insulinen in der Taufliege „Drosophila melanogaster" unter anderem von bestimmten Enzymen, den sogenannten Neprilysinen, reguliert.
„Tiere, in denen mit Hilfe genetischer Methoden die Aktivität eines dieser Neprilysine künstlich erhöht, beziehungsweise reduziert wurde, wiesen charakteristische Merkmale von Diabetes auf", berichtet Dr. Heiko Harten. Hierzu zählten beispielsweise eine erhöhte Glukose-Konzentration oder auch ein reduziertes Größenwachstum. Darüber hinaus war in diesen Tieren eine erheblich reduzierte Produktion von Insulinen festzustellen.
Präzise Regulation der Insulin-Produktion
Um die physiologische Basis der beobachteten Effekte genauer zu verstehen, analysierten die Osnabrücker Wissenschaftler eine Vielzahl an möglichen Substraten des relevanten Neprilysins und fanden, dass das Enzym bestimmte Faktoren abbaut, die im aktiven Zustand die Produktion von Insulinen auslösen. Demzufolge sind Neprilysine dafür verantwortlich, die Konzentration von entsprechenden Faktoren optimal abzustimmen, um somit eine präzise Regulation der Insulin-Produktion zu gewährleisten.
Der Osnabrücker Entwicklungsbiologe Dr. Harten zu den Ergebnissen der Studie: „Während bereits viel über die Funktionsweise von Insulin bekannt ist, ist unser Wissen über die Art und Weise, wie die Herstellung beziehungsweise die Freisetzung dieses Hormons reguliert wird, noch unvollständig. Die erfolgreiche Identifizierung eines bislang unbekannten Mechanismus zur Regulation der Insulin-Synthese stellt daher einen wichtigen Schritt hin zu einem vollständigeren Verständnis dieser Prozesse dar. Es ist wahrscheinlich, dass eine vergleichbare Regulation auch in höheren Organismen, bis hin zum Menschen, zu finden ist", so der Wissenschaftler.
Quelle: Universität Osnabrück
Publikation: Heiko Meyer et al.; Drosophila neprilysins control insulin signaling and food intake via cleavage of regulatory peptides; eLife, 2016; doi: 10.7554/eLife.19430