Lange galten sie als eine Verirrung der Biologie: Amyloide. Das sind fasrige Zusammenlagerungen aus kurzen Proteinstückchen. Ihren schlechten Ruf haben Amyloide deshalb, weil sie als Ursache von zahlreichen neurodegenerativen Erkrankungen, darunter Alzheimer, Parkinson oder Creutzfeldt-Jakob-Krankheit gelten.
Erst in der jüngeren Vergangenheit erkannten Forschende, dass Amyloide als strukturelle und funktionelle Bausteine in sehr vielen Lebensformen von Bakterien über Hefezellen und andere Pilze bis zum Menschen vorkommen. So spielen sie bei Wirbeltieren eine Rolle in der Produktion des Pigments Melanin, und Hefezellen bilden mit Amyloid-Aggregaten eine Art molekulares Gedächtnis.
Katalysatoren in der präbiotischen Evolution
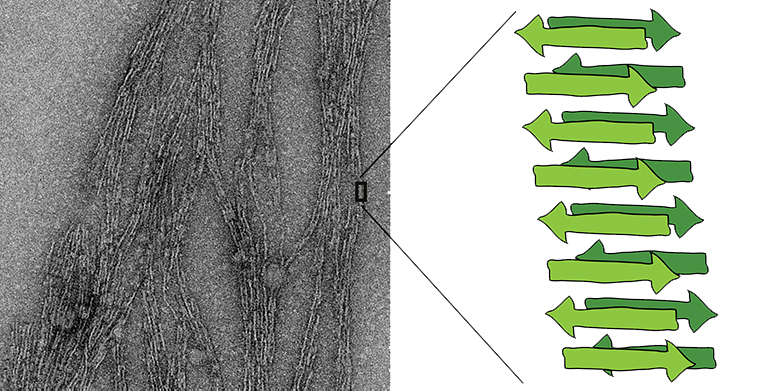 Links: Elektronenmikroskopische Aufnahme einer Amyloid-Faser. In Grün das Schema der für Amyloide charakteristischen Faltblattstruktur bestehend aus mehreren kürzeren Pepidketten. © ETH Zürich / Jason Greenwald
Links: Elektronenmikroskopische Aufnahme einer Amyloid-Faser. In Grün das Schema der für Amyloide charakteristischen Faltblattstruktur bestehend aus mehreren kürzeren Pepidketten. © ETH Zürich / Jason GreenwaldDa Amyloidfasern, die aus kurzen Peptiden zusammengesetzt sind, ähnlich wie Enzyme chemische Reaktionen beschleunigen können, werden sie seit ein paar Jahren als Kandidaten für die ersten Vorläufermoleküle des Lebens gehandelt.
Allerdings: Für diese Ursprungsrolle der Amyloide fehlte bislang der Nachweis einer wichtigen chemischen Eigenschaft: jener der Selbstvervielfältigung. Zu den frühen Verfechtern der so genannten „Amyloid-Hypothese" gehören ETH-Professor Roland Riek und sein Oberassistent Jason Greenwald vom Laboratorium für Physikalische Chemie.
In einem Experiment konnten sie nun zeigen, dass Amyloide als chemische Vorlage für die Synthese von kurzen Peptiden dienen können. Entscheidend dabei ist: „Diese Fähigkeit gilt potenziell auch für die Amyloide selbst, die Moleküle können sich also selber vervielfältigen", sagt Roland Riek.
Schablone für die Selbstkopie
Die Eigenschaft, sich selbst zu vermehren, gilt als unverzichtbare Voraussetzung für jegliche Frühform von Leben. Mit dem nun erbrachten Nachweis der Selbstreplikation bei Amyloiden zeigen Riek und sein Team nicht nur eine weitere verblüffende Facette dieser gemeinhin unterschätzten Proteine auf, sondern liefern auch ein weiteres Bindeglied, das bisher in der Argumentationskette der Amyloid-Hypothese fehlte.
Bereits knapp zwei Jahre zuvor wiesen die ETH-Wissenschaftler in einem Experiment nach, dass sich Amyloidstrukturen erstaunlich leicht spontan bilden können, aus einfachen Aminosäuren, die es auf der unbelebten Erde wahrscheinlich schon gab, und unter Reaktionsbedingungen, die für die so genannte Ursuppe ebenfalls plausibel scheinen. Gleiches gilt für die jetzt gefundene Peptidsynthese.
„Der Reaktionsmechanismus scheint allgemeiner Natur zu sein. Er verläuft stabil über weite Bereiche von Temperatur und Salzkonzentration sowohl in saurem als auch basischem Milieu", erklärt Greenwald. Diese Entdeckung bestärkt die Forscher nun in ihrer Vermutung, dass Amyloide früh in der Evolutionsgeschichte als Informationsträger und katalytische Einheiten eine zentrale Rolle bei der Entwicklung früher Lebensformen gespielt haben könnten.
Wohl keine reine „RNA-Welt“
 Schema der Selbstvervielfältung von Amyloid-Fasern: Stück für Stück lagern sich spezifische Aminosäuren (farbige Bausteine) am richtigen Ort an und verbinden sich chemisch. Das wachsende Amyloid dient dabei als Vorlage für sich selbst. © Lukas Frey / ETH Zürich
Schema der Selbstvervielfältung von Amyloid-Fasern: Stück für Stück lagern sich spezifische Aminosäuren (farbige Bausteine) am richtigen Ort an und verbinden sich chemisch. Das wachsende Amyloid dient dabei als Vorlage für sich selbst. © Lukas Frey / ETH ZürichDie bislang weitverbreitetste Idee für die molekularen Anfänge des Lebens ist jedoch die „RNA-Hypothese". Sie sieht ausschließlich Ribonukleinsäuren (RNA) als entscheidende Akteure in der präbiotischen Ursuppe. Dies, weil RNA-Moleküle ähnlich wie die Erbsubstanz, DNA-Informationen kodieren können, darüber hinaus aber zur Selbstreplikation fähig sind.
Am vorherrschenden Dogma der „RNA-Welt" kratzen nun die ETH-Forscher. Ihrer Ansicht nach ist die Amyloid-Hypothese nämlich plausibler. Dies einerseits, weil RNA-Moleküle mit einer biologischen Funktion ungleich viel größer und komplexer sind, so dass sie sich unter präbiotischen Bedingungen kaum spontan bilden können. „Andererseits sind Amyloide deutlich stabiler als frühe Nukleinsäurepolymere, und sie haben einen viel einfacheren abiotischen Syntheseweg verglichen mit der Komplexität bekannter katalytischer RNAs", sagt Greenwald.
Riek fügt an: „Beweisen, welche ‚Welt‘ die wahre ist, werden wir natürlich nie können, dafür müssten wir die letzten 4 bis 4,5 Milliarden Jahre Evolution zurückdrehen. Wir gehen aber ohnehin davon aus, dass nicht eine einzige, sondern mehrere molekulare ‚Welten‘ mit verschiedenen Vorläufermolekülen an der Entstehung des Lebens beteiligt waren."
Quelle: Eidgenössische Technische Hochschule Zürich (ETH Zürich)
Publikation: Greenwald J. et al.; A prebiotic template-directed peptide synthesis based on amyloids; Nature Communications, 2018; doi: 10.1038/s41467-017-02742-3