Krebs ist weltweit die zweithäufigste Todesursache. Bis vor Kurzem waren die Heilungschancen für Patienten mit einer metastatischen Krebserkrankung gering. Denn die Ableger des ursprünglichen Tumors in verschiedenen Organen können chirurgisch oder durch Radiotherapie meist schlecht oder gar nicht beseitigt werden.
Ebenso ist die Chemotherapie durch ihre schädlichen Nebenwirkungen limitiert. Seit einigen Jahren kommen Krebs-Immuntherapien zum Einsatz, die bei Patienten mit gewissen metastasierenden Tumoren eine gute Wirkung zeigen. Diese Immuntherapien, auch Checkpoint-Inhibitoren genannt, erlauben es dem körpereigenen Abwehrsystem, die Krebszellen besser zu erkennen und zu zerstören.
Das Problem ist, dass die Krebszellen mit der Zeit resistent gegenüber der ausgelösten Immunantwort werden. Nun haben Forschende der Universität Zürich und des UniversitätsSpitals Zürich einen Mechanismus entdeckt, der zentral ist bei der Entstehung dieser Resistenz.
Immunzellen erkennen resistente Krebszellen nicht
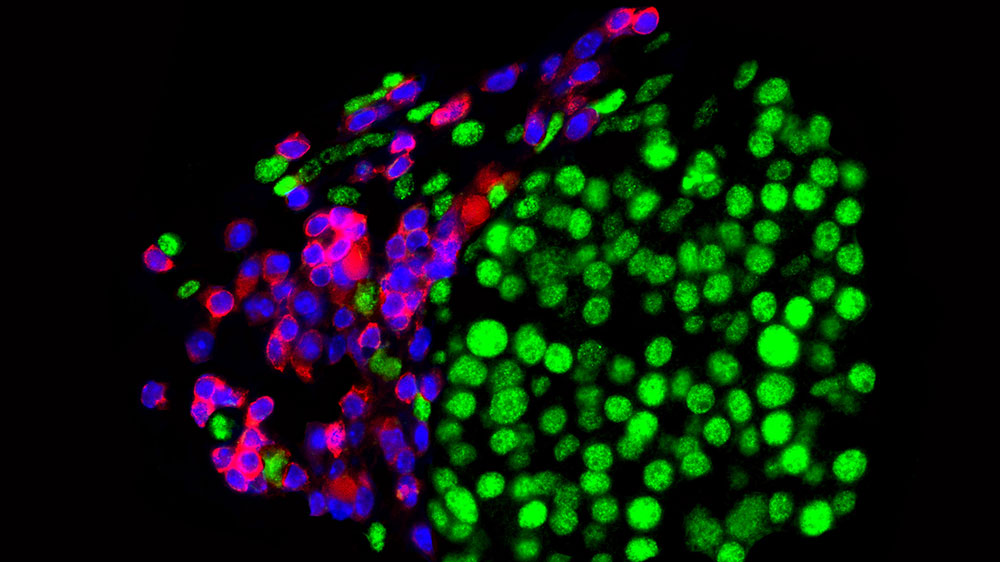
Ihre Resistenz entwickeln Krebszellen, indem sie diejenigen Merkmale herunterregulieren, dank derer die Immunzellen sie erkennen. Dazu gehört die Antigenpräsentation mittels sogenannten MHC-Klasse-I-Molekülen. Diese präsentieren tumorspezifische Strukturen auf der Zelloberfläche, so dass sie für die Abwehrzellen sichtbar werden.
Zudem produzieren Krebszellen spezifische Immunmoleküle und lösen immunhemmende Prozesse aus. Das Zusammenspiel dieser Veränderungen macht die Krebszellen für die Immunzellen quasi unsichtbar, wodurch die Immuntherapie unwirksam wird. „Die Mechanismen, die diesen Veränderungen zugrunde liegen, waren bislang jedoch mehrheitlich unbekannt", sagt Lukas Sommer, Professor für Anatomie an der Universität Zürich.
Bessere Wirkung durch Blockieren des Kontrollproteins
Das Team unter der Leitung von Onur Boyman, Direktor der Klinik für Immunologie am UniversitätsSpital Zürich, hat nun entdeckt, dass das epigenetische Kontrollprotein Ezh2 eine zentrale Rolle darin spielt, wie Krebszellen diese Resistenz entwickeln. Die Forschenden zeigen im Tiermodell, dass bei der Behandlung des schwarzen Hautkrebses mit Checkpoint-Inhibitoren oder mit dem immunstimulierenden Medikament Interleukin-2 die Tumormasse zu Beginn zwar abnimmt.
Doch mit der Zeit produzieren die Hautkrebszellen vermehrt Ezh2. Dadurch werden die antigenpräsentierenden MHC-Moleküle sowie die hautkrebsspezifischen Antigene unterdrückt, gleichzeitig erhöht sich die Aktivität von immunhemmenden Molekülen, welche die Abwehrzellen bremsen. Die Hautkrebszellen werden somit für das Immunsystem quasi unsichtbar und vermehren sich erneut unkontrolliert.
„Sobald wir die Aktivität des epigenetischen Regulators Ezh2 mit einem pharmakologischen Hemmstoff blockierten, wirkten die Immuntherapien besser. Die Tumormasse schrumpfte stärker und die krebsfreie Zeitspanne verlängerte sich", schließt Onur Boyman.
Quelle: Universität Zürich
Publikation: Onur Boyman et al.; The histone methyltransferase Ezh2 controls mechanisms of adaptive resistance to tumor immunotherapy; Cell Reports, 2017; DOI: 10.1016/j.celrep.2017.07.007