Das Tollwutvirus (RABV; Gattung Lyssavirus, Familie Rhabdoviridiae, Ordnung Mononegavirales) ist der Hauptverursacher der Tollwut bei an Land lebenden Säugetieren. Von dieser tödlichen Gefahr ist auch der Mensch massiv betroffen: Die Weltgesundheitsorganisation (WHO) schätzt die jährliche Zahl der Todesopfer auf mehr als 55 000.
Das RABV-Partikel besteht aus einer von Zellen abgeleiteten Membran, in der mehrere Kopien des sogenannten Oberflächenglykoproteins verankert sind, und einem helikalen Ribonukleoprotein (RNP), das an einem Ende eine konische Spitze bildet. Obwohl die einzelnen Bauteile des RNP bereits bisher bekannt waren, konnte die exakte Struktur des intakten RABV-RNP-Komplexes bisher nicht bestimmt werden.
Genau das ist nun jedoch einem Forschungsteam der Vetmeduni Vienna rund um Erstautorin Christiane Riedel und Letztautor Till Rümenapf gelungen, und zwar mittels Kryoelektronentomographie, ein bildgebendes Verfahren zur dreidimensionalen Darstellung feinster biologischer Strukturen, und einer daran anschließenden computerunterstützten Analyse durch Subtomogram Averaging.
Zwei Viren als ungleiche Geschwister: Ähnliche Struktur, anderes Aussehen
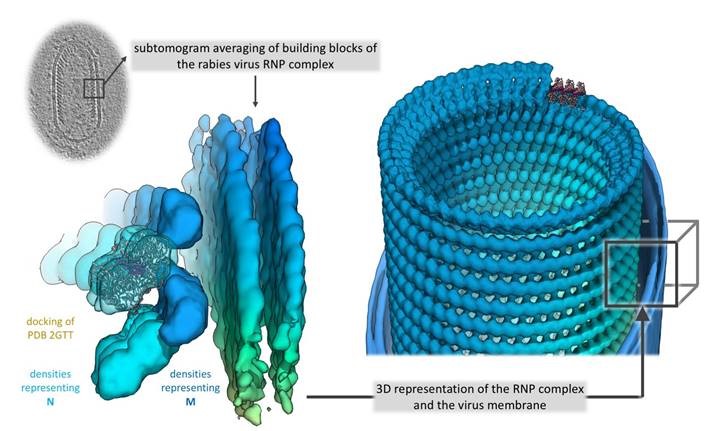 3D Ansicht des RNP (Ribonucleoprotein) Komplex des Tollwutvirus. © Christiane Riedel / Vetmeduni Vienna
3D Ansicht des RNP (Ribonucleoprotein) Komplex des Tollwutvirus. © Christiane Riedel / Vetmeduni ViennaDemnach besteht die Virusstruktur aus einer rechts-händigen Helix, die am 3’-Ende des Genoms im RNP-Konus lokalisiert ist, also gleich wie beim verwandten Virus der vesikulären Stomatitis (VSV), einer mild verlaufenden Viruskrankheit, die vor allem bei Huftieren auftritt und beim Menschen zu grippeähnlichen Symptomen führen kann.
„Die Verbindung benachbarter Helix-Windungen erfolgt beim Tollwutvirus allerdings über eine Interaktion des M-Proteins mit dem N-Protein, während eine M-M-Interaktion für VSV beschrieben wurde. Daraus resultiert, im Vergleich zu VSV, auch ein größerer Abstand der Helixwindungen zueinander und ein flacherer Winkel der einzelnen RNP-Windungen zur zentralen Virusachse. Dies demonstriert eine erstaunliche strukturelle Variabilität des RNPs zwischen VSV und RABV, obwohl die schon bestimmten Kristallstrukturen der Einzelbausteine, also der N- und M-Proteine, strukturell stark homolog sind. Oder anders gesagt: Obwohl die Einzelbausteine des Tollwutvirus und des VSV sehr ähnlich sind, unterscheiden sich die RNPs der beiden Viren deutlich in ihrer Architektur“, so Christiane Riedel zu den zentralen Studienergebnissen.
Quelle: Veterinärmedizinische Universität Wien
Originalpublikation: Christiane Riedel; Cryo EM structure of the rabies virus ribonucleoprotein complex; Scientific Reports, 2019, DOI: https://doi.org/10.1038/s41598-019-46126-7