Lebende Zellen gleichen einer hochorganisierten Kleinstadt – neben der Energieerzeugung, dem Transportsystem oder dem Baugewerbe benötigen Zellen auch eine effiziente Müllentsorgung. Denn die meisten Proteine, die der Zelle Form und Funktion verleihen, haben nur eine gewisse Halbwertzeit und müssen früher oder später, genauso wie defekte und unerwünschte Proteine, entsorgt werden.
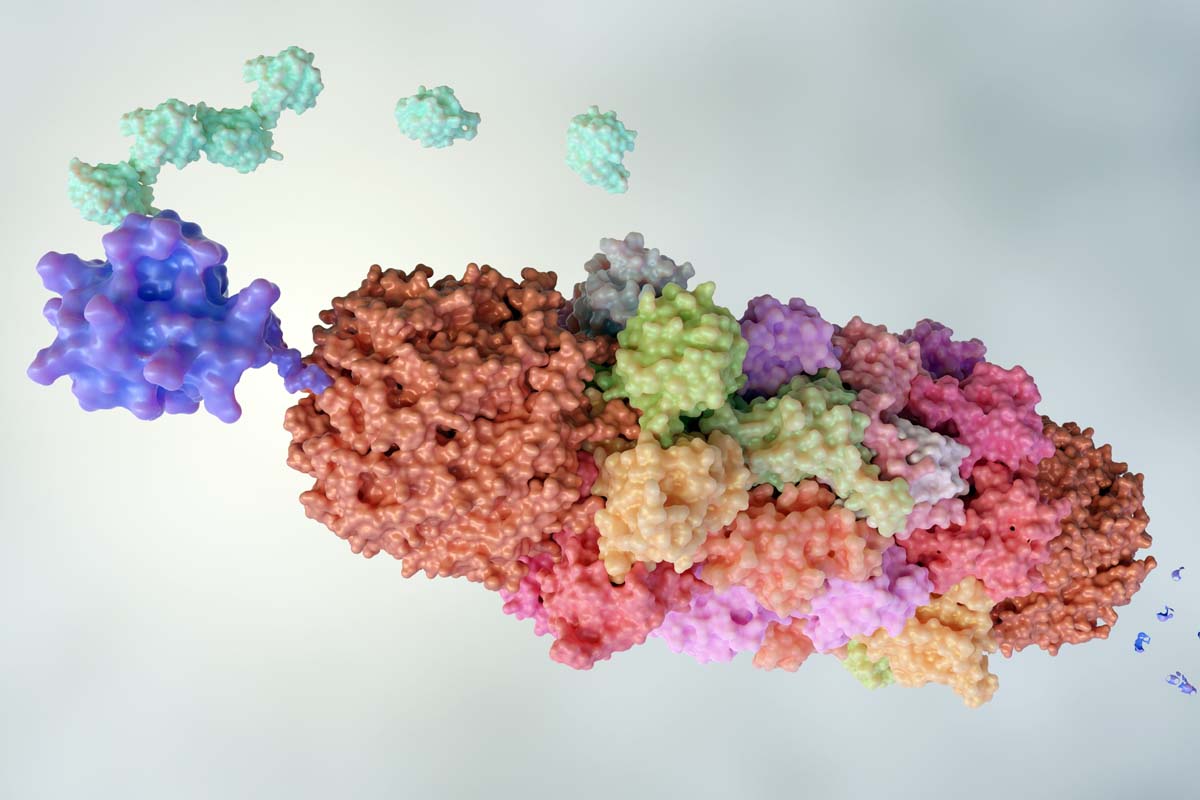
Diesen Job übernehmen spezielle Enzyme, die sogenannten Ubiquitin-Ligasen, die ausrangierte Proteine für den Abbau markieren, damit sie in die Recyclinganlage der Zelle, dem Proteasom, transportiert werden können. Die Markierung zum Abbau erfolgt dabei über die Anheftung eines Etikettes, genannt Ubiquitin: Ist es einmal an ein Protein geheftet, landet es zuverlässig im Proteasom.
Zellen sind jedoch nicht immer dazu in der Lage, jedes Protein zu erkennen, das ihnen schadet, und es entsprechend mit Ubiquitin zu versehen. So können viele Krankheiten wie Krebs oder neurodegenerative Erkrankungen wie Alzheimer erst dadurch entstehen, dass sich die krankmachenden Proteine in den Zellen anhäufen.
Zelleigenes Abfallsystem
Hier setzt die Forschung der Gruppe von Georg Winter am CeMM an: Mit einer Technik, die als „gezielte Proteindegradierung“ bezeichnet wird, kann man krankmachende oder anderweitig unerwünschte Proteine mit Ubiquitin markieren und im Proteasom zerstören lassen, also das zelleigene Abfallsystem quasi umprogrammieren.
Bisher funktionierte das auf eine von zwei Arten: Entweder, indem man einen chemischen Wirkstoff (sog. PROTACs) in die Zelle einführt, der sich auf einer Seite an das abzubauende Protein heftet, und auf der anderen Seite an die Ubiquitin-Ligase, was diese beiden direkt miteinander verbindet und zur Markierung des unerwünschten Proteins für den Abbau führt.
Oder, indem man eine Art „molekularen Kleber“ in die Zelle bringt, der an die Ligase angebracht wird und sie dadurch dazu bringt, das unerwünschte Protein zu erkennen und für den Abbau zu kennzeichnen. In der neuen Studie konnte das Team um Georg Winter (CeMM) und Alessio Ciulli (University of Dundee) einen dritten Weg aufzeigen, der beide bisherigen Strategien miteinander verbindet: Sogenannte „Intramolekulare bivalente Kleber“ (IBGs) binden an gleich zwei Stellen an das abzubauende Protein, verbiegen es dabei ein wenig und führen dadurch zu einer Veränderung seiner Oberfläche.
Therapie mit gezielter Proteindegradierung
Diese Veränderung wird von einer Ubiquitin-Ligase erkannt und das Protein folglich für den Abbau markiert. „Dieses Verfahren eröffnet uns völlig neue Möglichkeiten für die Entwicklung von Wirkstoffen, die etwa gegen Krebs eingesetzt werden können“, so Georg Winter.
„Zusammen mit den anderen Methoden der gezielten Proteindegradierung könnten damit viele Erkrankungen therapiert werden, die bisher auf keine der verfügbaren Medikamente angesprochen haben.“
„Bisher können wir Wirkstoffe, die zum gezielten Proteinabbau führen, oft nur durch Zufall entdecken. Je besser wir jedoch verstehen, wie dieses System funktioniert, desto näher kommen wir dem Ziel, solche Medikamente ganz gezielt entwerfen zu können“, sagt Matthias Hinterndorfer, Postdoktorand in Georg Winters Forschungsgruppe. Die neue Entdeckung liefert daher wichtige Einblicke in die Funktionsweisen und therapeutischen Möglichkeiten des gezielten Proteinabbaus.
Quelle: CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften
Publikation: Matthias Hinterndorfer et al.; Targeted protein degradation via intramolecular bivalent glues; Nature, 2024;DOI: 10.1038/s41586-024-07089-6