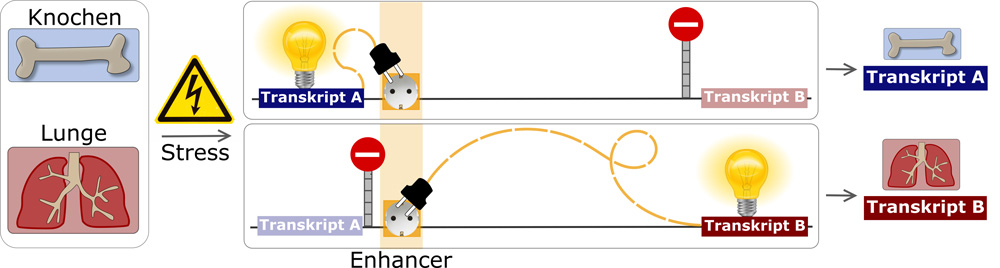
 In Knochenzellen aktiviert der Enhancer einen nahe gelegenen DNA-Abschnitt. In Lungenzellen wird ein Abschnitt aktiviert, der weit von dem Enhancer entfernt liegt. © S. Meijsing / Max-Planck-Institut für molekulare Genetik (MPIMG)
In Knochenzellen aktiviert der Enhancer einen nahe gelegenen DNA-Abschnitt. In Lungenzellen wird ein Abschnitt aktiviert, der weit von dem Enhancer entfernt liegt. © S. Meijsing / Max-Planck-Institut für molekulare Genetik (MPIMG)Das Herz pumpt schneller, die Atemfrequenz erhöht sich und der Blutdruck steigt. Dies alles sind Zeichen von akutem Stress. Während der Stressreaktion wird eine Mischung von Stresshormonen in den Blutkreislauf ausgeschüttet und zu den verschiedenen Geweben und Zelltypen unseres Körpers transportiert. Dadurch ist der gesamte Körper den Stresshormonen ausgesetzt. Aber obwohl alle Zellen mit Stresshormonen konfrontiert werden, antworten sie darauf mit einem breiten Spektrum an verschiedenen physiologischen Reaktionen. So werden beispielsweise in Fettzellen Energiereserven mobilisiert, während die Zellen des Immunsystems ihre Aktivität drosseln. Warum die Zellen so unterschiedlich auf die gleichen Stimuli reagieren können, obwohl sie alle das gleiche Genom besitzen, ist bisher weitgehend unklar.
Mit dieser Frage beschäftigen sich Sebastiaan Meijsing und sein Team am Max-Planck-Institut für molekulare Genetik (MPIMG) in Berlin. Es ist bekannt, dass viele physiologische Reaktionen auf Stress eine Folge von zelltypspezifischen Veränderungen der Genexpression sind. Beispielsweise können Zellen reagieren, indem sie die Anzahl an RNA-Abschriften (Transkripten) des Abschnitts der DNA, der bei Stress abgelesen wird, erhöhen oder erniedrigen. Um genauer zu untersuchen, wie Zellen auf Stresssignale reagieren, entfernten die Forscherinnen und Forscher um Meijsing mithilfe von Genome-Editing Enhancer aus dem Genom von Lungenzellen und überprüften, wie die veränderten Zellen auf Stress reagierten.
Auf diese Weise konnten sie mehrere Enhancer identifizieren, die für die stressinduzierten Veränderungen der Genexpression in diesem Zelltyp verantwortlich sind. Im nächsten Schritt untersuchten sie die Aktivität derselben Enhancer in einem anderen Zelltyp: Knochenzellen. Zu ihrer Überraschung war ein spezifischer Enhancer in den Knochenzellen jedoch an der stressinduzierten Regulation anderer Gentranskripte beteiligt als in den Lungenzellen. In den Knochenzellen wurde bei Stress ein DNA-Abschnitt aktiviert, der in direkter Nähe zum Enhancer liegt. In den Lungenzellen wurde dagegen ein anderes Transkript aktiviert, das sich in großer Entfernung zu dem betreffenden Enhancer befindet.
Organismus generiert verschiedene Produkte als Reaktion auf Stress
„Stellen sie sich vor, sie hätten nur eine Steckdose, mit dem sie entweder ihren Toaster oder ihren Wasserkocher betreiben können“, erklärt Meijsing. „Beides würde funktionieren, sie müssen sich aber für ein Gerät entscheiden. So ähnlich ist die Situation in diesen zwei Zelltypen. Der von uns untersuchte Enhancer kann entweder den benachbarten oder den weiter entfernt liegenden DNA-Abschnitt aktivieren.“ Wie aber entscheidet der Enhancer, welcher der beiden Genomabschnitte in welcher Zelle aktiviert werden muss? Im Zuge der Zelldifferenzierung und Ausbildung spezifischer Zellarten kommt es auch zu Unterschieden bei der dreidimensionalen Faltung des Genoms. Solche Unterschiede in der Art, wie das Genom gefaltet ist, können Interaktionen zwischen Enhancern und Genen bzw. anderen DNA-Abschnitten erlauben oder einschränken.
„Für die von uns untersuchte Region gibt es Hinweise, dass die Faltung des Genoms in den Knochenzellen eine Wechselwirkung des Enhancers mit der benachbarten DNA-Region ermöglicht“, sagt Meijsing. „In den Lungenzellen dagegen ist das Genom so gefaltet, dass der Enhancer nur mit dem weiter entfernt liegenden Abschnitt der DNA interagieren kann. Eine solche „Wiederverwendung“ von bereits vorhandenen Enhancern für verschiedene Gene ermöglicht es dem Organismus, verschiedene Produkte als Reaktion auf Stress zu generieren. Solch eine unterschiedliche Nutzung derselben aktiven Enhancer in verschiedenen Zelltypen kann somit zu den vielfältigen physiologischen Stressreaktionen unseres Körpers beitragen.“