Dabei setzten die Forscher einen Impfstoff ein, der aus zwei Komponenten besteht. Diese wurden den Affen zeitversetzt und in wechselnder Reihenfolge unter die Haut, über die Mundhöhle sowie als Muskelinjektion verabreicht. Die Wissenschaftler konnten zeigen, dass sowohl die Art der Auffrischungsimpfungen, also über die Mundhöhle oder über das Muskelgewebe, als auch die Reihenfolge der Impfstoffkomponenten die Aktivierung des Immunsystems beeinflussen.
Dies sind wichtige Faktoren, um eine Infektion mit SIV langfristig zu verhindern. Entscheidend ist dabei, dass die Menge der für die Immunabwehr wichtigen aktivierten körpereigenen CD4+-T-Helferzellen auch nach der Impfung relativ gering bleibt, da sich SIV und HIV hauptsächlich dort vermehren. Um einen dauerhaften Impfschutz gegen AIDS zu erreichen, muss deshalb eine Impfstrategie entwickelt werden, bei der eine ausbalancierte Immunantwort erreicht wird, ohne dass die Anzahl der CD4+-T-Helferzellen zu stark ansteigt.
Hürden für den Impfstoff
 Dr. Ulrike Sauermann (links), Wissenschaftlerin in der Abteilung Infektionsmodelle, und Prof. Christiane Stahl-Hennig (rechts), Leiterin der Abteilung Infektionsmodelle. Gemeinsam mit einem internationalen Forscherteam haben sie eine neue Impfstrategie gegen AIDS getestet. © Karin Tilch
Dr. Ulrike Sauermann (links), Wissenschaftlerin in der Abteilung Infektionsmodelle, und Prof. Christiane Stahl-Hennig (rechts), Leiterin der Abteilung Infektionsmodelle. Gemeinsam mit einem internationalen Forscherteam haben sie eine neue Impfstrategie gegen AIDS getestet. © Karin TilchFür das Fehlen eines Impfstoffes gegen die HIV-Infektion gibt es viele Gründe. Im Gegensatz zu konventionellen Impfstoffen muss der Wirkstoff gegen HIV eine Immunantwort auslösen, die so stark ist, dass keine einzige Zelle infiziert wird, da das Virus sonst dauerhaft in das Erbgut der Zelle eingeschleust wird. Dies ist bei anderen Impfstoffen nicht notwendig, da sich die meisten Viren nicht fest im Genom verankern.
Hier reicht eine Impfantwort aus, die schneller reagiert als sich das Virus in den Zellen ausbreiten und „Schaden“ anrichten kann. Eine weitere Hürde für einen Impfstoff gegen AIDS ist das Immunsystem selbst. Damit das körpereigene Abwehrsystem eine optimale Immunantwort auslösen kann, werden CD4+-T-Helferzellen benötigt. Das Dilemma für die Impfstoffforschung ist, dass ausgerechnet diese Zellen auch die Zielzellen sind, die von HIV oder SIV befallen werden.
Ulrike Sauermann und Christiane Stahl-Hennig, Wissenschaftlerinnen in der Abteilung Infektionsmodelle am Deutschen Primatenzentrum, haben nun in einer internationalen Kooperation mit italienischen und österreichischen Partnern, einer US-amerikanischen Forschergruppe und deutschen Experten aus Erlangen, Bochum und Kiel einen Impfansatz getestet, der diese kritischen Faktoren berücksichtigt.
Anregen und verstärken
Die Forscher verabreichten zwölf Rhesusaffen, die als Modelltiere für die menschliche HIV-Infektion eingesetzt wurden, einen potentiellen Impfstoff bestehend aus zwei Komponenten. Das Verabreichen eines zusammengesetzten Impfstoffs bezeichnet man als Prime-Boost- (Start-Verstärker) Immunisierung. Im ersten Schritt wurden alle Affen mit genetisch veränderten SI-Viren behandelt, die die Wirtszellen zwar infizieren, sich jedoch danach nicht weiter im Körper vermehren können.
Dieses Vorgehen dient zum „ersten Anregen“ des Immunsystems (Priming). Danach wurden die Affen in zwei Gruppen geteilt, die die zweite Impfkomponente, bestehend aus zwei verschiedenen viralen Vektoren, auf unterschiedlichem Wege erhielten. Die nicht krankmachenden Vektoren dienen als Genfähren, um Bestandteile von SIV, wie zum Beispiel Hüllproteine, in die Zielzellen zu schleusen. Dieser zweite Schritt dient zur Verstärkung der Immunreaktion (Boost). Sechs Affen erhielten im ersten Schritt eine Adenovirus-Genfähre, die ihnen oral als Spray verabreicht wurde.
Im zweiten Schritt bekamen sie eine Muskelinjektion mit einer Genfähre aus dem Geflügelpockenvirus. Bei den anderen sechs Affen verfuhren die Wissenschaftler andersherum. Hier wurde zuerst der Geflügelpockenvektor oral und danach der Adenovirusvektor als Injektion verabreicht. Anschließend wurden die Affen niedrigen Dosen des Affenimmundefizienzvirus, welches eine AIDS-ähnliche Erkrankung auslöst, in wöchentlichen Abständen solange ausgesetzt, bis fast alle Affen infiziert waren.
Reihenfolge spielt große Rolle
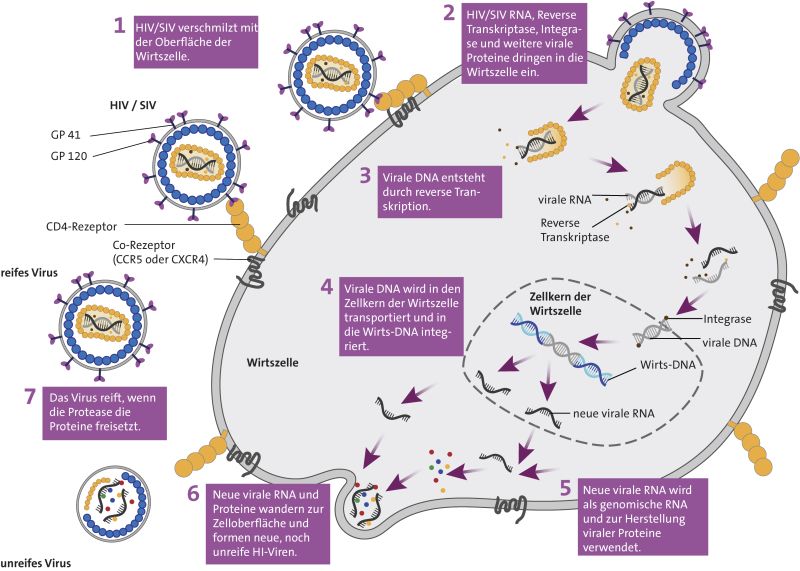 Replikationszyklus des humanen (HIV) bzw. Affenimmundefizienzvirus (SIV). Das Virus vermehrt sich unter anderem in körpereigenen CD4+-T-Helferzellen. Dabei schleust es seine eigene Erbinformation in die DNA der Wirtszelle ein. Von dort aus wird neue virale RNA synthetisiert, mit deren Hilfe neue Virusbestandteile gebildet werden. Diese reifen dann zu infektiösen HIV/SIV Partikeln heran. © Luzie J. Almenräder
Replikationszyklus des humanen (HIV) bzw. Affenimmundefizienzvirus (SIV). Das Virus vermehrt sich unter anderem in körpereigenen CD4+-T-Helferzellen. Dabei schleust es seine eigene Erbinformation in die DNA der Wirtszelle ein. Von dort aus wird neue virale RNA synthetisiert, mit deren Hilfe neue Virusbestandteile gebildet werden. Diese reifen dann zu infektiösen HIV/SIV Partikeln heran. © Luzie J. Almenräder„Wir beobachteten, dass sich das Virus in allen geimpften Tieren anfänglich weniger vermehrte als in der Kontrollgruppe“, fasst Ulrike Sauermann, Erstautorin der Studie, die Ergebnisse zusammen. „Das zeigt, dass bei allen immunisierten Affen eine schützende Immunreaktion durch den Impfstoff ausgelöst wurde.
In der zweiten Gruppe, die zuerst mit dem Geflügelpockenvektor und danach mit dem Adenovirusvektor behandelt wurde, war jedoch die Infektionswahrscheinlichkeit um etwa 70 Prozent reduziert, gegenüber einer nur zwölfprozentigen Reduktion in der ersten Gruppe. Außerdem waren in der zweiten Gruppe die CD4+-T-Helferzellen weniger stark aktiviert.“
Die Daten zeigen, dass die Reihenfolge und die Art der Verabreichung (Oralspray oder Injektion) der Impfstoffe die Aktivierung des Immunsystems beeinflussen und eine Langzeitwirkung haben können, die den Effekt nachfolgender Immunisierungen sowie die Infizierbarkeit beeinflussen. Deshalb ist es wichtig, eine Balance zwischen der T-Helferzellantwort und den übrigen Immunantworten zu finden. Eine zu starke Aktivierung der CD4+-T-Helferzellen kann sonst die schützende Immunantwort aufheben.
Mögliche Risiken erkennen und vermeiden
„Im ungünstigen Fall kann eine Immunisierung gegen HIV die Infektion begünstigen, wie Ergebnisse aus einer AIDS–Impfstoffstudie beim Menschen belegen“, sagt Christiane Stahl-Hennig, die gemeinsam mit dem früheren DPZ-Mitarbeiter Sieghart Sopper die Affenstudie konzipiert hatte.
„Die Studie wurde am Menschen durchgeführt, obwohl eine vergleichbare Impfstrategie im Affen fehlgeschlagen war. Sorgfältig geplante und durchgeführte Tierversuche sind deshalb als vorklinische Studien essentiell, um mögliche Risiken, die durch eine Impfung gegen AIDS entstehen könnten, zu erkennen und zu vermeiden. Wir glauben, dass wir eine wirksame Komponente für einen zusammengesetzten Impfstoff gefunden haben. Die Immunisierung mit SIV-Komponenten in einem Geflügelpockenvektor scheint sicher und erfolgversprechend zu sein. In folgenden Versuchen wollen wir nun die Booster-Immunisierung weiter verbessern, um eine noch höhere Effizienz und Schutzrate zu erzielen.“
Quelle: Deutsches Primatenzentrum GmbH – Leibniz-Institut für Primatenforschung
Originalpublikation: Stahl-Hennig, C et al.; Vector order determines protection against pathogenic simian immunodeficiency virus infection in a triple component vaccine by balancing CD4+ and CD8+ T-cell responses; Journal of Virology, 2017; doi: 10.1128/JVI.01120-17