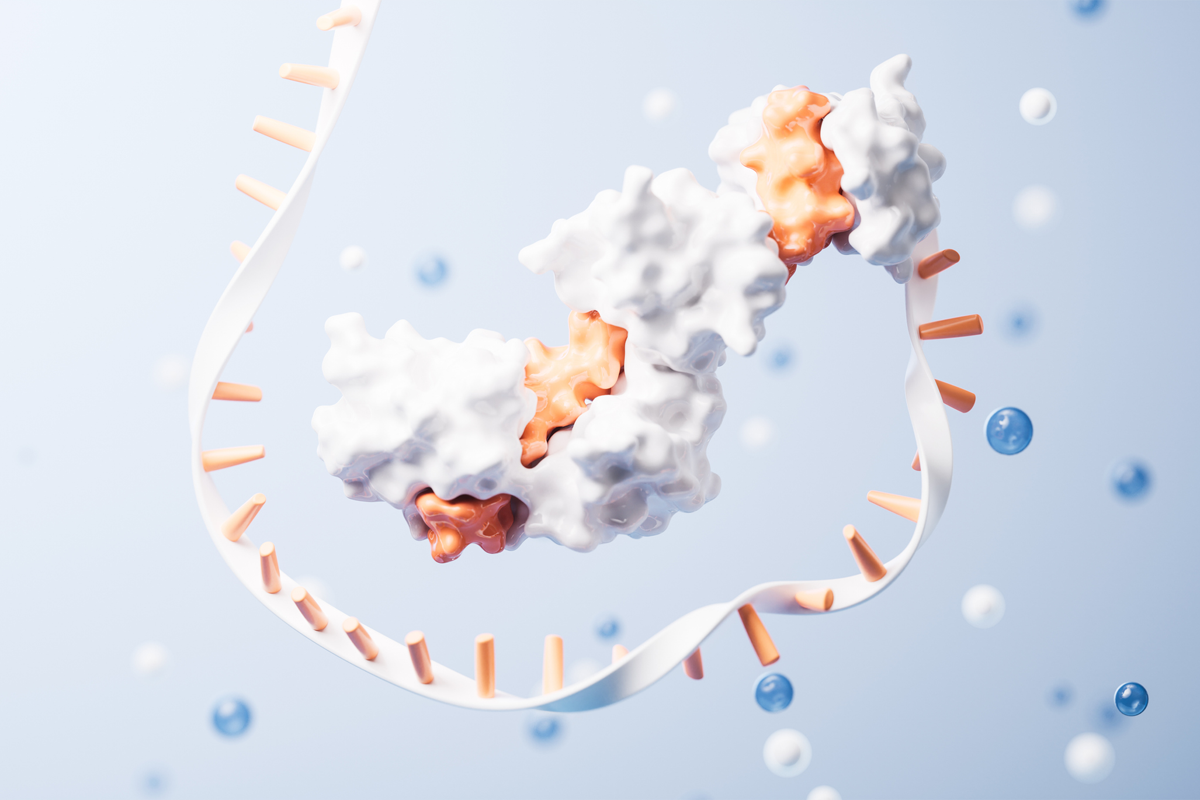
Modell eines Sclerostin-Fragments (grün) gebunden an den Antikörper AbD09097 © Thomas Müller
Modell eines Sclerostin-Fragments (grün) gebunden an den Antikörper AbD09097 © Thomas MüllerBei der Suche nach verbesserten Arzneimitteln setzt die Forschung unter anderem auf das Protein Sclerostin, das im Knochenstoffwechsel eine Rolle spielt. Hemmt man seine Funktion, wird der Knochenabbau unterdrückt. Erste klinische Studien mit einem Sclerostin-hemmenden Antikörper der Firmen Amgen und UCB zeigten eine Zunahme der Knochenmasse bei Osteoporose-Patienten. Aktuell laufen weiterführende Studien unter anderem in Würzburg, München und Dresden.
Verena Boschert, Postdoc im Team des Strukturbiologen Professor Thomas Müller am Julius-von-Sachs-Institut der Universität Würzburg, befasst sich ebenfalls mit dem Protein Sclerostin. In einem von der Europäischen Union und der Deutschen Forschungsgemeinschaft geförderten Projekt war es eines der Ziele, gemeinsam mit den Projektpartnern neue Antikörper zu erzeugen, die sich gegen Sclerostin richten.
Dabei haben die Wissenschaftler jetzt erstmals einen gegen Sclerostin wirksamen Antikörper in kristalliner Form dargestellt und seine Wirkungsweise genauer analysiert. „Sie könnten das Design neuer, hochwirksamer Antikörper gegen Sclerostin vorwärts bringen”, so Boschert.
Kooperation mit zwei Unternehmen
Die Würzburger Forscher kooperieren bei diesen Arbeiten mit der Industrie. Mit der Firma AbD Serotec, die ihre deutsche Niederlassung in Puchheim hat, wurden zuerst rund zehn Antikörper entwickelt, die vielversprechend schienen.
In Zellkulturen zeigte sich dann, dass genau einer davon (AbD09097) gegen Sclerostin wirksam ist. Gemeinsam mit der Firma Pepscan (Lelystad / Niederlande) und dem Leibniz-Institut für molekulare Pharmakologie in Berlin wurden außerdem ein sogenanntes Epitop-Mapping und NMR-Studien durchgeführt. Diese Analysenmethoden brachten zutage, an welcher Stelle genau sich der Antikörper an Sclerostin heftet.
„Bislang haben wir nur den Antikörper kristallisiert und untersucht“, sagt Boschert. Als nächstes ist nun geplant, den Antikörper gemeinsam mit dem Abschnitt von Sclerostin zu kristallisieren, an den er bindet. Auf diese Weise sollten sich noch detailliertere Informationen über die Art und Weise der Bindung gewinnen lassen.
Quelle: Julius-Maximilians-Universität Würzburg
Publikation: T. D. Mueller et al.; The sclerostin-neutralizing antibody AbD09097 recognizes an epitope adjacent to sclerostin’s binding site for the Wnt co-receptor LRP6; Open Biology, 2016; DOI: 10.1098/rsob.160120