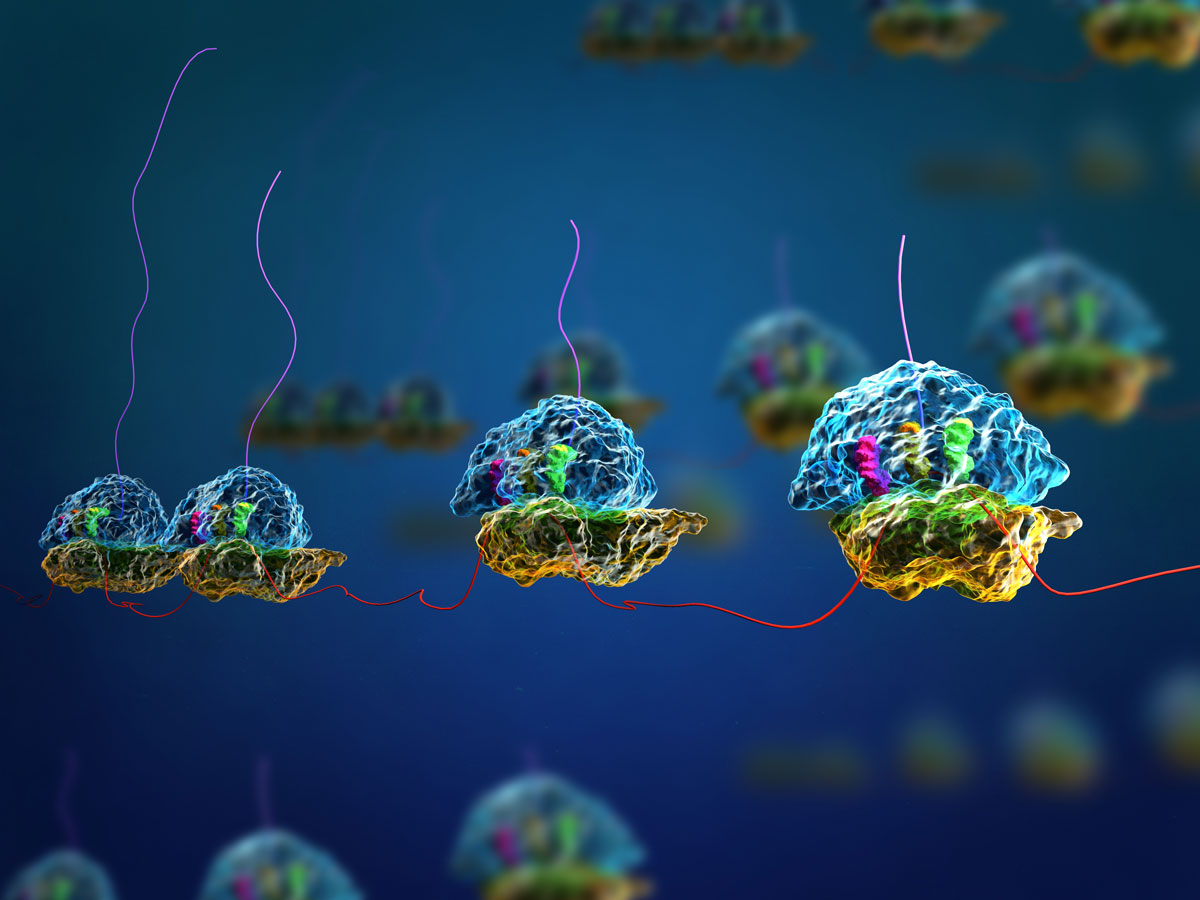
Sie sind die Orte der Eiweißsynthese: An Ribosomen wird die genetische Information, die auf der sogenannten Boten-RNA gespeichert ist, abgelesen und in Proteine übersetzt. Sie sind also für alle Organismen lebenswichtig. Wenn sie ein Protein erzeugt haben, aber auch, wenn fehlerhafte Proteine im Ribosom steckenbleiben, müssen die Ribosomen ‘recycelt‘ werden, um sie für eine neue Syntheserunde funktionsfähig zu machen.
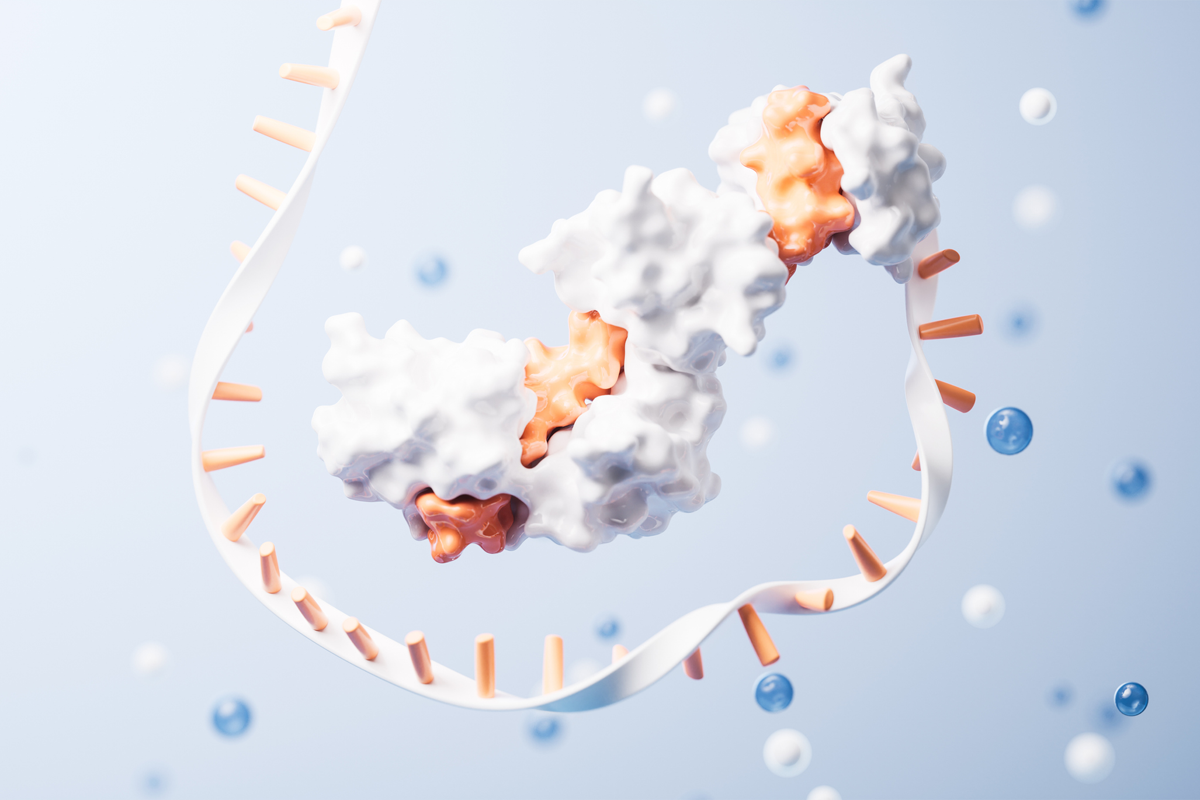
In allen Organismen (außer in Bakterien) koordiniert das hochkonservierte Enzym ABCE1 diesen Vorgang, bei dem die Ribosomen in ihre beiden Untereinheiten zerlegt werden. Der LMU-Biophysiker Thorben Cordes hat in Kooperation mit Robert Tampé (Universität Frankfurt) und Wissenschaftlern an der Universität Groningen (Niederlande) mithilfe eines neuartigen biophysikalischen Ansatzes gezeigt, dass ABCE1 unerwartet vielfältige räumliche Konformationen einnimmt, um das Recycling voranzutreiben.
Das Enzym ABCE1 kann das Molekül ATP, sozusagen die Energiewährung der Zelle, spalten und die dabei gewonnene Energie in die Trennung der beiden Ribosomen-Untereinheiten stecken.
Vielfältige Funktionen von ABCE1
„Jüngste strukturelle und funktionelle Daten haben gezeigt, dass dabei ein Konformationswechsel des Enzyms, also eine Änderung seiner räumlichen Struktur für die vielfältigen Funktionen von ABCE1, unerlässlich ist“, sagt Cordes.
Sein Team hat nun mit einem integrierten Versuchsansatz, unter anderem mithilfe der sogenannten Einzelmolekül-FRET-Methode, die Formvariabilität von ABCE1 auf Einzelmolekülebene direkt beobachtet. Dabei stellten die Wissenschaftler fest, dass die beiden ATP-Bindestellen von ABCE1 nicht nur zwei, sondern sogar drei Konformationen einnehmen können, die sich in einem dynamischen Gleichgewicht befinden: offen, intermediär und geschlossen.
Die Interaktion von ABCE1 mit dem Ribosom und das zur Verfügung stehende ATP beeinflussen die strukturelle Dynamik beider ATP-Stellen und führt zu einem komplexen Netzwerk unterschiedlicher Zustände, wobei Ribosom und ATP das Gleichgewicht in Richtung der geschlossenen Formen verschieben. „Wir gehen davon aus, dass die Konformationen funktionell unterschiedliche Rollen bei der Ribosomenspaltung aber auch für die anderen vielfältigen Funktionen von ABCE1 haben“, sagt Cordes.