Die Mitochondrien versorgen die Zelle mit Energie. Sie besitzen auch ihre eigene DNA, die stets und nur von der Mutter an die Nachkommen vererbt wird. Das mitochondriale Erbgut kann auch defekte Gene tragen. Solche Mutationen in Mitochondrien-Genen verursachen häufig Erkrankungen des Nervensystems, weil Nervenzellen besonders viel Energie benötigen.
Seit kurzem kann man den Ausbruch von mitochondrialen Erkrankungen schon vor der Geburt des Kindes verhindern. Dafür werden die defekten Mitochondrien der mütterlichen Eizelle gegen solche von gesunden Spendern ausgetauscht. So entstehen Kinder mit drei genetischen Eltern: die DNA im Zellkern stammt von Mutter und Vater, die der Mitochondrien vom Spender.
In Deutschland ist dieser Eingriff in die Keimbahn jedoch verboten. Diese nur präventiv wirksame Strategie hilft außerdem nicht jenen Menschen, die bereits defekte Gene in ihren Mitochondrien tragen. An der Lösung dieses Problems arbeitet MDC-Forscher Dr. Alessandro Prigione.
Schwierige Forschung
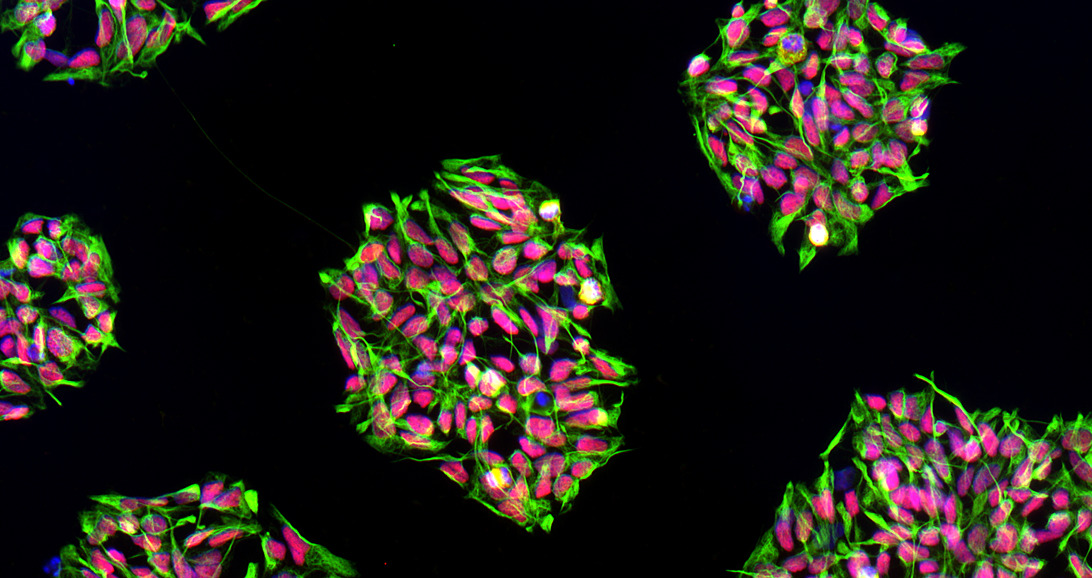
 Nervenzellen entwickeln sich aus Kolonien neuronaler Vorläuferzellen, die von menschlichen induzierten pluripotenten Stammzellen abgeleitet wurden. © Gizem Inak, AG Prigione, MDC
Nervenzellen entwickeln sich aus Kolonien neuronaler Vorläuferzellen, die von menschlichen induzierten pluripotenten Stammzellen abgeleitet wurden. © Gizem Inak, AG Prigione, MDC„Es gibt keine guten Modellsysteme für mitochondriale Krankheiten, weil wir das Genom der Mitochondrien nicht gezielt verändern können. Auch die heute verbreiteten Zellkultur-Systeme bilden die Bedingungen in menschlichen Nervenzellen nicht gut genug nach“, sagt der Wissenschaftler. Das mangelnde Verständnis darüber, wie die Krankheit menschliche Neuronen beeinflusst, ist ein bedeutender Hinderungsgrund bei der Erforschung mitochondrialer Erkrankungen.
Auch die Suche nach neuen Arzneistoffen leidet unter dieser Forschungslücke. Bevor man Patienten potenzielle Medikamente verabreicht, muss ihre Wirkung auf Zellen getestet werden. Hierbei sind insbesondere die von der Krankheit betroffenen Zellen interessant, denn Wirksubstanzen und genetische Defekte können abhängig vom Zelltyp sehr unterschiedliche Auswirkungen haben. Diese Probleme könnten Prigione und sein Team nun auf einen Schlag gelöst haben.
Neuartiges Testsystem
Mit seiner Doktorandin Carmen Lorenz vom MDC und dem Berliner Institut für Gesundheitsforschung (BIH) entwickelte er zusammen mit weiteren Forschungsgruppen vom MDC und aus Frankreich eine zellbasierte Teststrategie für die Wirkstoffsuche. Die Forscher gewinnen dafür Hautzellen von Erkrankten, die sie in einen ursprünglicheren Zustand zurückversetzen – es entstehen induzierte pluripotente Stammzellen (iPS-Zellen).
Diese Zellen werden im nächsten Schritt zum Beispiel in Nervenzellen umgewandelt. „Das zelluläre Testsystem sollte dem Zustand der Nervenzellen in den Erkrankten sehr nahekommen. Das war eine grundlegende Anforderung“, sagt Prigione. „In unseren Untersuchungen entdeckten wir, dass ein bestimmtes Vorläuferstadium von Nervenzellen genau die erwünschten Eigenschaften aufweist und gleichzeitig hervorragend für großangelegte Wirkstoff-Screenings geeignet ist.“
Diese künstlich erzeugten Zellen ähnelten den Nervenzellen der Betroffenen: Auch jene Zellen wiesen ein Ungleichgewicht in ihrem Kalzium-Haushalt auf und stellten zu wenig Energie bereit.
Vielversprechende Vorversuche
Als nächstes testeten die Forschenden 130 Substanzen an den neuronalen Vorläuferzellen, die bereits als Arzneimittel gegen andere Krankheiten zugelassen waren. Sie identifizierten das Medikament Avanafil, das die Kalzium-Balance in den Zellen teilweise wiederherstellen konnte.
Laut Prigione sind diese Ergebnisse äußerst vielversprechend: „Avanafil ist bereits zugelassen. Wir können es also direkt für klinische Studien im Menschen benutzen, daran arbeiten wir derzeit. Außerdem können wir mit dem neuen Modellsystem nun mehrere Tausend zugelassene Medikamente testen. Daraus ergibt sich ein großes Potenzial für die personalisierte Therapie – und zwar auch sehr seltener Krankheiten.“
Quelle: Max-Delbrück-Centrum für Molekulare Medizin (MDC)
Publikation: Alessandro Prigione et al.; Human iPSC-derived neuronal progenitors are an effective drug discovery model for neurological mitochondrial DNA disorders; Cell Stem Cell., 2017; doi: 10.1016/j.stem.2016.12.013