Ähnliche Mechanismen seien beim Menschen nicht auszuschließen, so Andreas F.H. Pfeiffer, Leiter der Abteilung Klinische Ernährung am DIfE. Wie Wissenschaftler weltweit beobachten, besitzen Kinder von adipösen Müttern ein höheres Risiko für Übergewicht und Stoffwechselerkrankungen. Neuere Studienergebnisse lassen annehmen, dass als Ursache hierfür auch ernährungsbedingte epigenetische Effekte eine Rolle spielen könnten.
Da Mensch und Maus genetisch sehr ähnlich sind, nutzen viele Wissenschaftler Mausmodelle, um solche Zusammenhänge unter kontrollierten Bedingungen zu erforschen. Am Menschen sind solche Studien nicht möglich. Im Fokus der aktuellen Studie standen dabei die epigenetischen Effekte auf die GIP-regulierten Stoffwechselwege, die während der Schwangerschaft und Stillzeit durch die Ernährung ausgelöst werden.
GIP ist ein Hormon, das der Darm nach der Nahrungsaufnahme freisetzt und welches die Insulinausschüttung aus der Bauchspeicheldrüse stimuliert. Es beeinflusst den Stoffwechsel von Fettzellen sowie die Fettverbrennung in der Skelettmuskulatur und fördert als anaboles Hormon den Aufbau von Körpermasse. Seine Effekte vermittelt GIP über den sogenannten GIP-Rezeptor.
Fehlt dieser wie bei der Gipr-/–Maus, so kann das Hormon seine natürliche Wirkung nicht mehr entfalten und die Tiere sind normalerweise vor Übergewicht und Insulinresistenz geschützt. Da sich die GIP-regulierten Stoffwechselwege anhand des Gipr-/–Mausmodells gut untersuchen lassen, verwendeten die Forscher diesen Mausstamm für ihre Studie. Als Kontrolle diente der Wildtyp-Stamm des Mausmodells.
Unterschiedliche Testgruppen
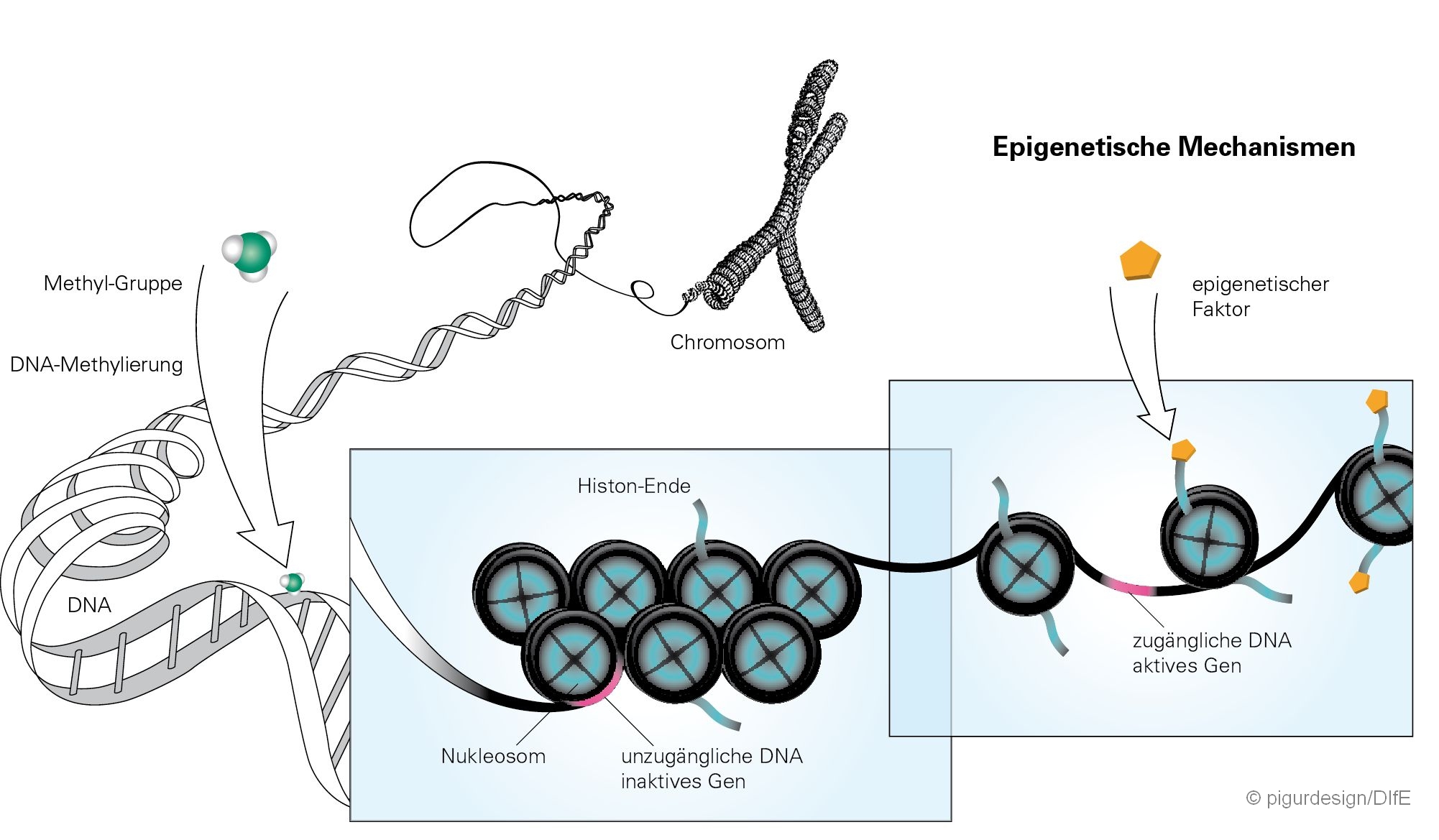 Epigenetische Mechanismen im Schema. © pigurdesign / DIfE
Epigenetische Mechanismen im Schema. © pigurdesign / DIfEZunächst teilten die Forscher die Mausmütter in drei Gruppen ein, die während der Trag- und Stillzeit unterschiedliches Futter erhielten:
• Gruppe 1: Gipr-/–Mäuse, die fettreiches Futter erhielten
• Gruppe 2: Gipr-/–Mäuse, die normales Futter erhielten
• Gruppe 3: Wildtyp-Mäuse mit intaktem GIP-Rezeptor, die normales Futter erhielten
Alle Nachkommen der drei Gruppen bekamen nach dem Abstillen für 22 Wochen normales Futter und im Anschluss daran für weitere 20 Wochen eine fettreiche Kost. Wie die Wissenschaftler beobachteten, nahmen die erwachsenen Nachkommen der Gruppe 1 und 3 unter der 20-wöchigen fettreichen Diät deutlich an Fettmasse zu, obwohl sie weniger fraßen als der Nachwuchs von Gruppe 2.
Ebenso hatten sie erhöhte Cholesterin-, Zucker- und Insulinspiegel im Blut, wiesen vermehrt entzündliche Reaktionen im Fettgewebe auf, hatten größere Fettzellen und verbrannten weniger Fett in der Muskulatur. Zudem stellten die Forscher fest, dass die Aktivität verschiedener Gene bei Gruppe 1 und 3 im Vergleich zu Gruppe 2 verändert war.
Bei diesen handelt es sich um Gene, die für die Fettverbrennung im Muskel und für Entzündungsprozesse im Fettgewebe eine Rolle spielen, oder die an der Regulation der Energieaufnahme durch das Gehirn beteiligt sind. „Die veränderten Genaktivitäten ließen sich dabei zum Teil auf DNA-Methylierungen, das heißt, epigenetische Veränderungen zurückführen“, sagt Pfeiffer.
„Unsere Ergebnisse weisen zudem darauf hin, dass GIP auch für die durch das Gehirn gesteuerte Regulation der Energieaufnahme eine Rolle spielt, indem es vermutlich indirekt die Insulinempfindlichkeit des Hypothalamus vermindert“, so der Endokrinologe weiter. Dies sei eine ganz neue Erkenntnis.
Inwieweit sich die Ergebnisse auf den Menschen übertragen ließen, müsse man sehen. Hier sei noch sehr viel zu erforschen. Fest stehe jedoch, dass die Ernährung nicht nur direkten Einfluss auf ein Individuum hat, sondern auch noch dessen Nachkommen beeinflussen kann.
Quelle: Deutsches Institut für Ernährungsforschung Potsdam-Rehbrücke
Weitere Informationen
Publikation: Michael Kruse et al.; A High Fat Diet during Mouse Pregnancy and Lactation targets GIP-regulated Metabolic Pathways in Adult Male Offspring; American Diabetes Association, 2015; DOI: 10.2337/db15-0478