Prof. Dr. Annette Schürmann © DifE
Prof. Dr. Annette Schürmann © DifENach Aussage der Weltgesundheitsorganisation ist die Zahl der übergewichtigen Menschen weltweit auf über eine halbe Milliarde angestiegen und wird auch künftig weiter zunehmen. Ein Trend, der besorgniserregend ist, denn Übergewicht erhöht das Risiko für Krankheiten wie Typ-2-Diabetes, die nichtalkoholische Fettleber, Herzinfarkt, Schlaganfall und bestimmte Krebsarten.
Dennoch ist nicht jeder Mensch gleichsam anfällig für Übergewicht und seine Folgeerkrankungen. Das heißt, auch die familiäre Herkunft beeinflusst das individuelle Risiko für Übergewicht. Allerdings erklären die bislang identifizierten Genvarianten nur etwa fünf Prozent der familiären Vorbelastung. Diese Diskrepanz legt nahe, dass auch noch andere vererbbare Faktoren eine Rolle spielen, wie zum Beispiel epigenetische Veränderungen des Erbguts. Hierzu zählen unter anderem DNA-Methylierungen.
Diese verändern den genetischen Code nicht. Sie können aber dazu beitragen, dass beispielsweise Gene weniger stark abgelesen werden, so dass die Zellen geringere Mengen der entsprechenden Proteine produzieren. Hierdurch kann es unter anderem zu Stoffwechselstörungen kommen. Bereits im Jahr 2013 zeigte ein Forscherteam aus Dresden, dass Personen, die unter Typ-2-Diabetes und einer Fettleber leiden, geringere Mengen des Proteins IGFBP2 in der Leber produzieren.
Gleichzeitig konnten sie nachweisen, dass die verminderte IGFBP2-Freisetzung mit einer erhöhten DNA-Methylierungsrate verschiedener Gene einhergeht. Um zu prüfen, inwieweit die verringerte Proteinfreisetzung auf die epigenetischen Veränderungen zurückzuführen ist, untersuchten die Wissenschaftler um Annette Schürmann die Zusammenhänge nun an einem geeigneten Mausmodell, der sogenannten C57BL/6J-Maus.
Epigenetische Veränderung macht nicht nur Mäuse anfälliger
Ähnlich wie eineiige Zwillinge sind alle Tiere dieses Zuchtstamms genetisch identisch. Dennoch nehmen einige der Mäuse unter einer fettreichen Ernährung viel stärker zu als andere und entwickeln im Erwachsenenalter mit etwa 20 Wochen eine Fettleber. Wie die Forscher zeigen, war bei diesen Tieren bereits im Alter von 6 Wochen das Igfbp2-Gen stärker methyliert, also epigenetisch verändert, und gleichzeitig die IGFBP2-Synthese in der Leber deutlich verringert.
Ebenso traten bei diesen Mäusen schon sehr früh erste Zuckerstoffwechselstörungen auf. Wie weitere molekularbiologische Untersuchungen der Wissenschaftler zeigten, trägt die Methylierung im nicht-codierenden Bereich des Igfbp2-Gens zu der verminderten IGFBP2-Synthese bei. Auch in menschlichen Blutzellen von Personen, die unter krankhaftem Übergewicht litten und deren Zuckerstoffwechsel bereits gestört war, wiesen die Forscher dieselbe epigenetische Veränderung im humanen Gen nach.
„Unsere Ergebnisse weisen darauf hin, dass die von uns untersuchte epigenetische Veränderung Mäuse sowie Menschen für Übergewicht anfälliger macht und gleichzeitig deren Risiko erhöht, mit fortschreitendem Lebensalter eine Fettleber zu entwickeln“, sagt Anne Kammel, Erstautorin der Studie.
„Da die Methylierung des Gens bereits sehr früh auftritt, weit bevor sich eine Fettleber entwickelt hat, wäre es denkbar, dieses Wissen zu nutzen, um das Erkrankungsrisiko bereits bei Jugendlichen und jungen Erwachsenen besser einzuschätzen. Man hätte so die Möglichkeit, der Erkrankung durch geeignete Maßnahmen rechtzeitig vorzubeugen“, ergänzt Schürmann.
Quelle: Deutsches Institut für Ernährungsforschung (DifE)
Publikation: Anne Kammel et al.; Early hypermethylation of hepatic Igfbp2 results in its reduced expression preceding fatty liver in mice; Hum. Mol. Genet., 2016; doi: 10.1093/hmg/ddw121
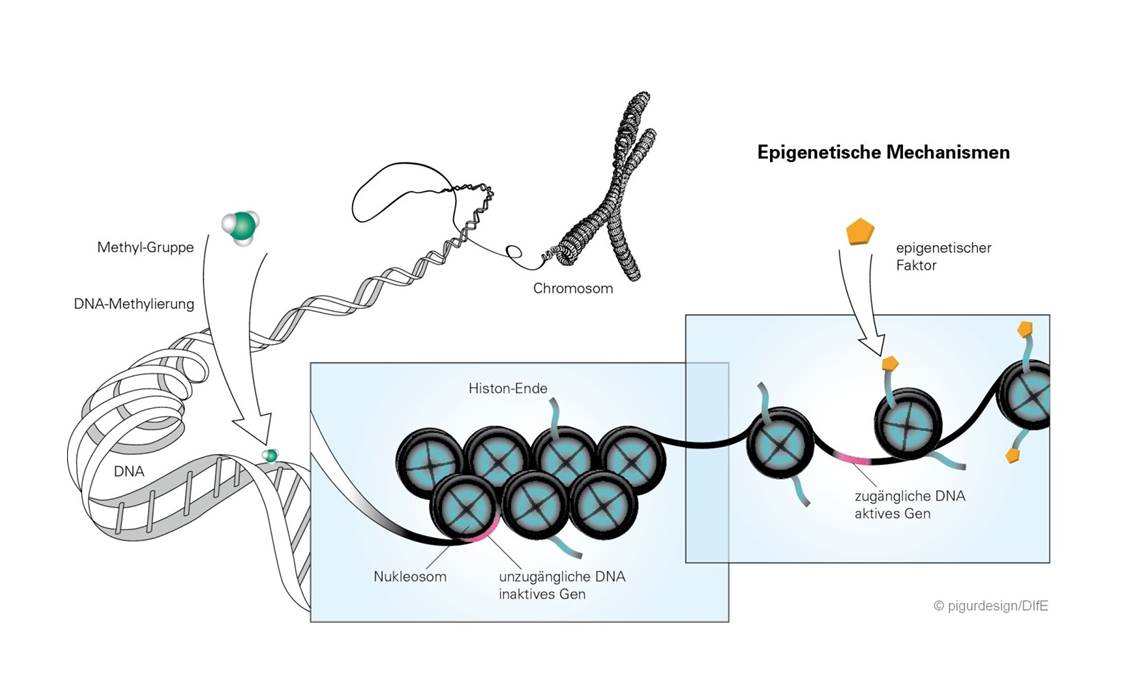
Erklärungen zur Abbildung:
DNA-Methylierungen entstehen, wenn Methylgruppen an die DNA binden. Diese können Gene entweder aktivieren oder deaktivieren.
Nukleosom: Acht Histonproteine bilden den Kern eines Nukleosoms, auf das 147 Basenpaare eines DNA-Stranges aufgewickelt sind.
Histon-Ende: Die Enden der Histone ragen aus dem Nukleosom heraus und können durch epigenetische Faktoren modifiziert werden. Hierdurch wird die Bindung der DNA an das entsprechende Nukleosom verändert, so dass die DNA z.B. für Transkriptionsenzyme zugänglich und ein bestimmtes Gen aktiviert wird.
Epigenetische Faktoren verändern Histon-Enden indem sie z.B. Methyl- oder Acetylgruppen auf Lysin-Seitenketten übertragen. Dies kann die Aktivierung eines Gens erschweren bzw. erleichtern. Die direkte Methylierung der DNA verändert dann dauerhaft die Genexpression, wenn sie in Steuerbereichen von Genen erfolgt (sogenannten CpG-Inseln), die durch die Modifikation der Histone zugänglich gemacht wurden.